–°—А–Њ—З–љ–∞—П –њ—Г–±–ї–Є–Ї–∞—Ж–Є—П –љ–∞—Г—З–љ–Њ–є —Б—В–∞—В—М–Є
+7 995 770 98 40
+7 995 202 54 42
info@journalpro.ru
–ѓ–≤–ї–µ–љ–Є–µ —Г—Б—В–Њ–є—З–Є–≤–Њ–є —Н–ї–µ–Ї—В—А–Њ—Е–Є–Љ–Є—З–µ—Б–Ї–Њ–є –Ј–∞—Й–Є—В—Л –Љ–µ—В–∞–ї–ї–Њ–≤ –Њ—В –Ї–Њ—А—А–Њ–Ј–Є–Є.
–†—Г–±—А–Є–Ї–∞: –Ґ–µ—Е–љ–Є—З–µ—Б–Ї–Є–µ –љ–∞—Г–Ї–Є
–Ц—Г—А–љ–∞–ї: «–Х–≤—А–∞–Ј–Є–є—Б–Ї–Є–є –Э–∞—Г—З–љ—Л–є –Ц—Г—А–љ–∞–ї вДЦ9 2015» (—Б–µ–љ—В—П–±—А—М 2015)
–Ъ–Њ–ї–Є—З–µ—Б—В–≤–Њ –њ—А–Њ—Б–Љ–Њ—В—А–Њ–≤ —Б—В–∞—В—М–Є: 3491
–Я–Њ–Ї–∞–Ј–∞—В—М PDF –≤–µ—А—Б–Є—О –ѓ–≤–ї–µ–љ–Є–µ —Г—Б—В–Њ–є—З–Є–≤–Њ–є —Н–ї–µ–Ї—В—А–Њ—Е–Є–Љ–Є—З–µ—Б–Ї–Њ–є –Ј–∞—Й–Є—В—Л –Љ–µ—В–∞–ї–ї–Њ–≤ –Њ—В –Ї–Њ—А—А–Њ–Ј–Є–Є.
–†–µ–≤–∞—И–Є–љ –С–Њ—А–Є—Б –У–µ–љ–љ–∞–і—М–µ–≤–Є—З
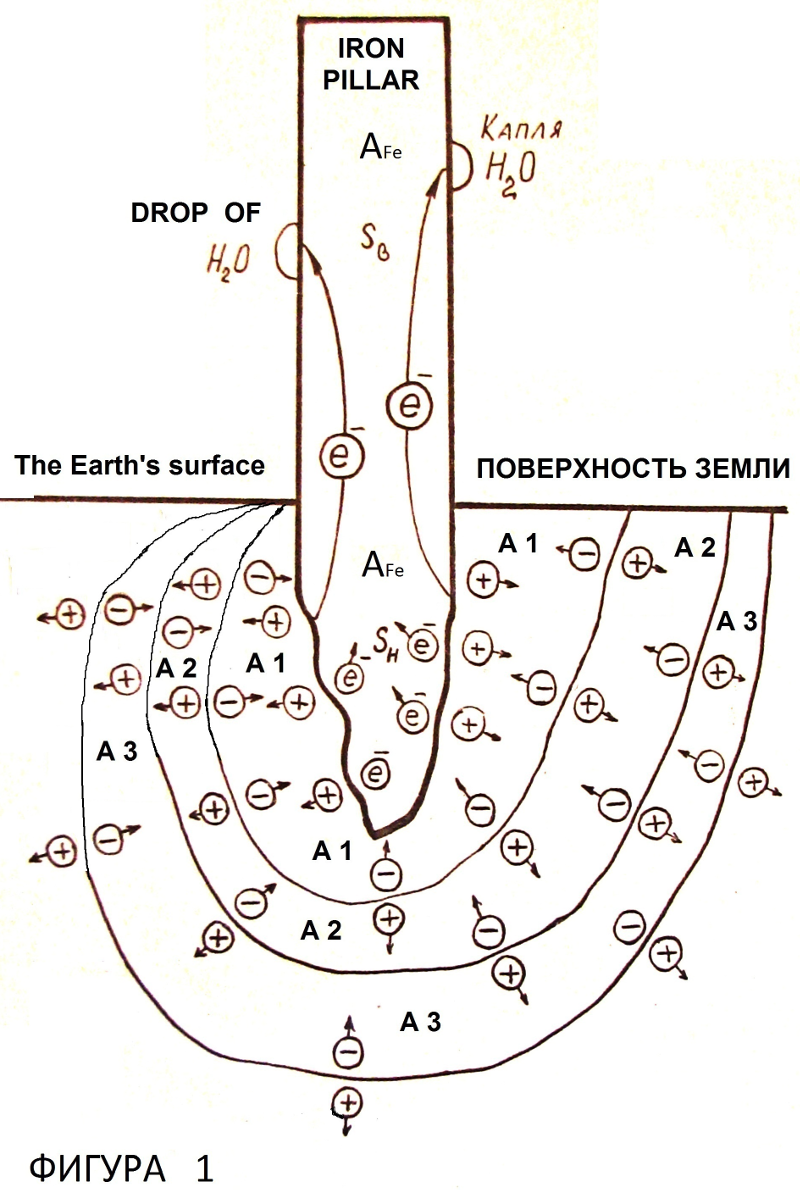
–£—Б—В–Њ–є—З–Є–≤–∞—П —Н–ї–µ–Ї—В—А–Њ—Е–Є–Љ–Є—З–µ—Б–Ї–∞—П –Ј–∞—Й–Є—В–∞ –Њ—В –Ї–Њ—А—А–Њ–Ј–Є–Є, –ґ–µ–ї–µ–Ј–љ—Л–є —Б—В–Њ–ї–± –Ь–Є–љ–∞—А–µ—В–∞ –Ъ—Г—В—Г–± вАУ –Ь–Є–љ–∞—А –≤ –Ф–µ–ї–Є, –Ш–љ–і–Є—П.
–Т –Є–љ–і–Є–Є, –≤ –≥–Њ—А–Њ–і–µ –Ф–µ–ї–Є –ґ–µ–ї–µ–Ј–љ—Л–є —Б—В–Њ–ї–± —Б—В–Њ–Є—В –±–µ–Ј –≤–Є–і–Є–Љ—Л—Е —Г—Б—В—А–Њ–є—Б—В–≤ –∞–љ—В–Є–Ї–Њ—А—А–Њ–Ј–Є–Њ–љ–љ–Њ–є —Н–ї–µ–Ї—В—А–Њ—Е–Є–Љ–Є—З–µ—Б–Ї–Њ–є –Ј–∞—Й–Є—В—Л –±–Њ–ї–µ–µ —В—Л—Б—П—З–Є –ї–µ—В –±–µ–Ј –Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є—П –Ї–Њ—А—А–Њ–Ј–Є–Є. –Т –і–≤–∞–і—Ж–∞—В–Њ–Љ –≤–µ–Ї–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞—В–µ–ї–Є –Њ—В–њ–Є–ї–Є–ї–Є –Ї—Г—Б–Њ—З–µ–Ї –ґ–µ–ї–µ–Ј–∞ –Њ—В —Б—В–Њ–ї–±–∞ –і–ї—П –Њ–њ—А–µ–і–µ–ї–µ–љ–Є—П –µ–≥–Њ —Е–Є–Љ–Є—З–µ—Б–Ї–Њ–≥–Њ —Б–Њ—Б—В–∞–≤–∞. –Я—А–Є–≤–µ–Ј–ї–Є –Њ–±—А–∞–Ј–µ—Ж –≤ –ї–∞–±–Њ—А–∞—В–Њ—А–Є—О –Є –Њ–±–љ–∞—А—Г–ґ–Є–ї–Є –µ–≥–Њ –Ї–Њ—А—А–Њ–Ј–Є–Њ–љ–љ–Њ–µ –њ–Њ—А–∞–ґ–µ–љ–Є–µ [–Ы6, —Б—В—А. 122]. –°–ї–µ–і–Њ–≤–∞—В–µ–ї—М–љ–Њ, –њ—А–Њ—В–Є–≤–Њ–Ї–Њ—А—А–Њ–Ј–Є–Њ–љ–љ–∞—П —Г—Б—В–Њ–є—З–Є–≤–Њ—Б—В—М –ґ–µ–ї–µ–Ј–љ–Њ–≥–Њ —Б—В–Њ–ї–±–∞ –Ь–Є–љ–∞—А–µ—В–∞ –Ъ—Г—В—Г–± вАУ –Ь–Є–љ–∞—А –Њ–±—Г—Б–ї–Њ–≤–ї–µ–љ–∞ —Б–≤–Њ–є—Б—В–≤–∞–Љ–Є –Љ–∞—В–µ—А–Є–∞–ї–Њ–≤ –њ–Њ–і —Б—В–Њ–ї–±–Њ–Љ (—Д–Є–≥—Г—А–∞ 1).
–Ш–Ј–≤–µ—Б—В–љ–Њ, —З—В–Њ —Н–љ–µ—А–≥–Є—П, –љ–µ–Њ–±—Е–Њ–і–Є–Љ–∞—П –і–ї—П –≤—Л—Е–Њ–і–∞ —Н–ї–µ–Ї—В—А–Њ–љ–∞ –Є–Ј —В–≤—С—А–і–Њ–≥–Њ —В–µ–ї–∞ –≤ –≤–∞–Ї—Г—Г–Љ –≤ —Б–Њ—Б—В–Њ—П–љ–Є–µ —Б –Ї–Є–љ–µ—В–Є—З–µ—Б–Ї–Њ–є —Н–љ–µ—А–≥–Є–µ–є, —А–∞–≤–љ–Њ–є –љ—Г–ї—О, –љ–∞–Ј—Л–≤–∞–µ—В—Б—П —Н–Љ–Є—Б—Б–Є–Њ–љ–љ–Њ–є –њ–Њ—Б—В–Њ—П–љ–љ–Њ–є, –Є–ї–Є —А–∞–±–Њ—В–Њ–є –≤—Л—Е–Њ–і–∞ [–Ы3, —Б—В—А. 107, –Ы4, —Б—В—А. 129]. –≠–Љ–Є—Б—Б–Є–Њ–љ–љ—Л–µ –њ–Њ—Б—В–Њ—П–љ–љ—Л–µ, –Њ—В–љ–Њ—Б—П—Й–Є–µ—Б—П –Ї —З–Є—Б—В—Л–Љ –Њ–±—А–∞–Ј—Ж–∞–Љ, –Є–Љ–µ—О—В—Б—П –≤ —Б–њ—А–∞–≤–Њ—З–љ–Є–Ї–∞—Е –њ–Њ —Д–Є–Ј–Є–Ї–µ [–Ы4, —Б—В—А. 160, 161].
–Ґ–Р–С–Ы–Ш–¶–Р 1. –≠–Љ–Є—Б—Б–Є–Њ–љ–љ—Л–µ –њ–Њ—Б—В–Њ—П–љ–љ—Л–µ –ґ–µ–ї–µ–Ј–∞ F–µ, –Ї—А–µ–Љ–љ–Є—П Si, –∞–ї—О–Љ–Є–љ–Є—П Al, –±–∞—А–Є—П Ba, —Ж–µ–Ј–Є—П Cs –Є –Ї–∞—В–Њ–і–љ—Л—Е –Љ–∞—В–µ—А–Є–∞–ї–Њ–≤ Ba-W, BaO-SrO, BaO-W, Ba-WO:
| Fe | Si | Al | –Т–∞ | Ba-W | BaO-SrO | –°s | Ba-O-W | Ba-WO |
| 4,36 —Н–Т | 4,10 —Н–Т | 3,74 –≠–≤ | 2,29 —Н–Т | 1,56 —Н–Т | 1,37 —Н–Т | 1,36 —Н–Т | 1,34 —Н–Т | 1,10 —Н–Т |
–†–∞–Ј–ї–Є—З–љ—Л–µ –Љ–µ—В–∞–ї–ї—Л, –њ–Њ–ї—Г–њ—А–Њ–≤–Њ–і–љ–Є–Ї–Њ–≤—Л–µ –Љ–∞—В–µ—А–Є–∞–ї—Л –Є —Е–Є–Љ–Є—З–µ—Б–Ї–Є–µ —Б–Њ–µ–і–Є–љ–µ–љ–Є—П –Є–Љ–µ—О—В —А–∞–Ј–љ—Г—О –≤–µ–ї–Є—З–Є–љ—Г —Н–Љ–Є—Б—Б–Є–Њ–љ–љ–Њ–є –њ–Њ—Б—В–Њ—П–љ–љ–Њ–є –Р. –Ъ–Њ–Љ–±–Є–љ–∞—Ж–Є–Є –Љ–µ—В–∞–ї–ї–Є—З–µ—Б–Ї–Є—Е –њ–ї—С–љ–Њ–Ї –Є –Њ–Ї—Б–Є–і–љ—Л—Е —Б–ї–Њ—С–≤ –Є—Б–њ–Њ–ї—М–Ј—Г—О—В—Б—П –≤ —Н–ї–µ–Ї—В—А–Њ–љ–љ–Њ–є —В–µ—Е–љ–Є–Ї–µ –≤ –Ї–∞—З–µ—Б—В–≤–µ –Ї–∞—В–Њ–і–Њ–≤ –і–ї—П —Н–Љ–Є—Б—Б–Є–Є —Н–ї–µ–Ї—В—А–Њ–љ–љ—Л—Е –њ—Г—З–Ї–Њ–≤ –≤ –≤–∞–Ї—Г—Г–Љ –Є–ї–Є –≥–∞–Ј–Њ–≤—Л–µ —Б—А–µ–і—Л. –Я–ї—С–љ–Њ—З–љ—Л–µ –Є –Њ–Ї—Б–Є–і–љ—Л–µ –Ї–∞—В–Њ–і—Л –Є–Љ–µ—О—В –Љ–∞–ї—Г—О –≤–µ–ї–Є—З–Є–љ—Г —Н–Љ–Є—Б—Б–Є–Њ–љ–љ–Њ–є –њ–Њ—Б—В–Њ—П–љ–љ–Њ–є –≤ –њ—А–µ–і–µ–ї–∞—Е 1,1вАУ2,5 —Н–ї–µ–Ї—В—А–Њ–љ вАУ –Т–Њ–ї—М—В.
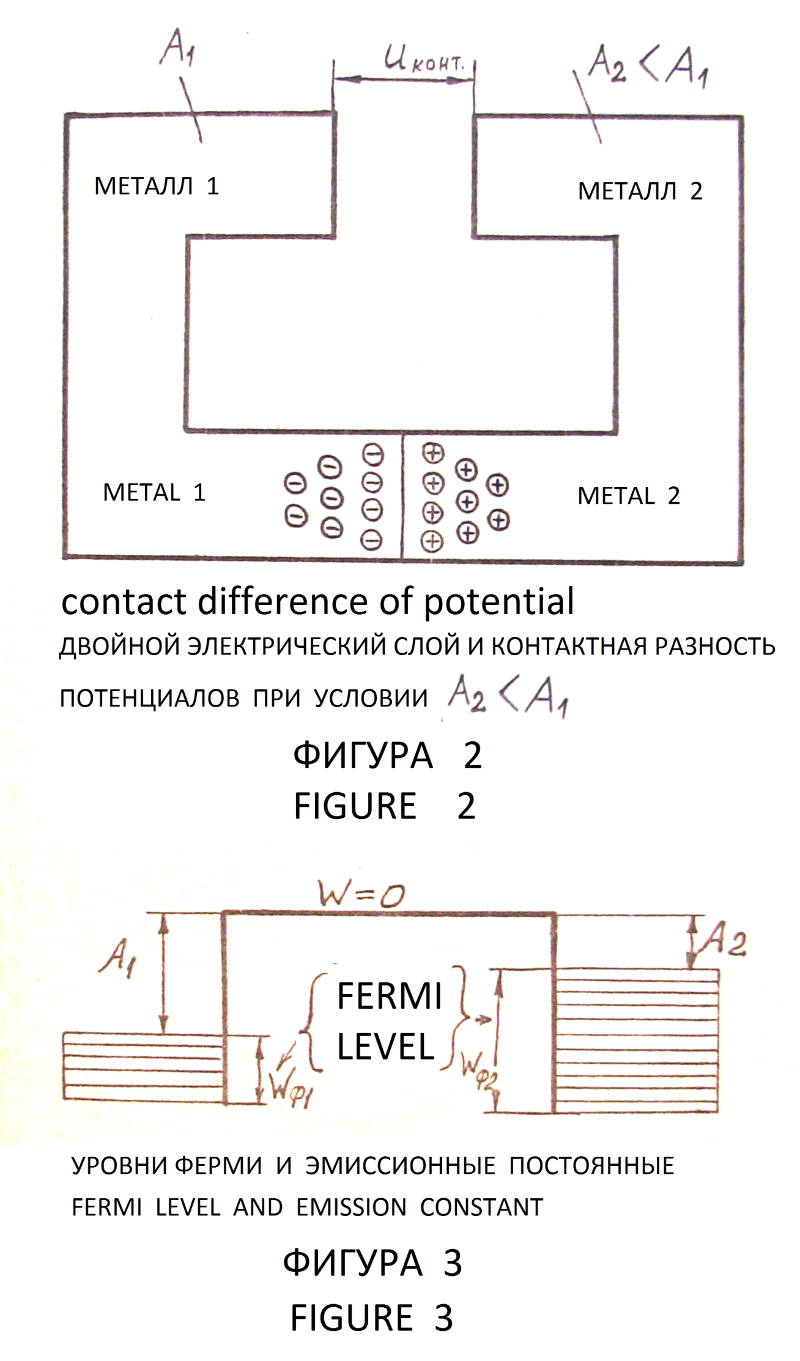
–Я—А–Є —Б–Њ–µ–і–Є–љ–µ–љ–Є–Є –і–≤—Г—Е —В–≤—С—А–і—Л—Е —В–µ–ї —Б —А–∞–Ј–љ—Л–Љ–Є –≤–µ–ї–Є—З–Є–љ–∞–Љ–Є —Н–Љ–Є—Б—Б–Є–Њ–љ–љ–Њ–є –њ–Њ—Б—В–Њ—П–љ–љ–Њ–є –≤–Њ–Ј–љ–Є–Ї–∞–µ—В –Ї–Њ–љ—В–∞–Ї—В–љ–∞—П —А–∞–Ј–љ–Њ—Б—В—М –њ–Њ—В–µ–љ—Ж–Є–∞–ї–Њ–≤ –љ–∞ –≥—А–∞–љ–Є—Ж–µ —В–≤—С—А–і—Л—Е —В–µ–ї –Ј–∞ —Б—З–µ—В –њ–µ—А–µ—Е–Њ–і–∞ —Н–ї–µ–Ї—В—А–Њ–љ–Њ–≤ –Є–Ј —В–≤—С—А–і–Њ–≥–Њ —В–µ–ї–∞ —Б –Љ–µ–љ—М—И–µ–є –≤–µ–ї–Є—З–Є–љ–Њ–є —Н–Љ–Є—Б—Б–Є–Њ–љ–љ–Њ–є –њ–Њ—Б—В–Њ—П–љ–љ–Њ–є –≤ —В–≤—С—А–і–Њ–µ —В–µ–ї–Њ —Б –±–Њ–ї—М—И–µ–є –≤–µ–ї–Є—З–Є–љ–Њ–є —Н–Љ–Є—Б—Б–Є–Њ–љ–љ–Њ–є –њ–Њ—Б—В–Њ—П–љ–љ–Њ–є (—Д–Є–≥—Г—А—Л 2, 3). –Ґ–≤—С—А–і—Л–µ —В–µ–ї–∞ вАУ —Н—В–Њ –Љ–µ—В–∞–ї–ї—Л, –њ–Њ–ї—Г–њ—А–Њ–≤–Њ–і–љ–Є–Ї–Є, –і–Є—Н–ї–µ–Ї—В—А–Є–Ї–Є, —Е–Є–Љ–Є—З–µ—Б–Ї–Є–µ —Б–Њ–µ–і–Є–љ–µ–љ–Є—П, –љ–∞–њ—А–Є–Љ–µ—А –Њ–Ї—Б–Є–і–љ—Л–µ –њ–ї—С–љ–Ї–Є [–Ы3, —Б—В—А. 111вАУ118]. –Т –Ј–∞–≤–Є—Б–Є–Љ–Њ—Б—В–Є –Њ—В –Ї–Њ–љ—Д–Є–≥—Г—А–∞—Ж–Є–Є, —Н–ї–µ–Ї—В—А–Є—З–µ—Б–Ї–Њ–є –Є —В–µ–њ–ї–Њ–≤–Њ–є —С–Љ–Ї–Њ—Б—В–Є, —В–µ–Љ–њ–µ—А–∞—В—Г—А—Л —Б–Њ–њ—А–Є–Ї–∞—Б–∞—О—Й–Є—Е—Б—П —В–≤—С—А–і—Л—Е —В–µ–ї –Ј–∞—А—П–і—Л –Љ–Њ–≥—Г—В –њ–µ—А–µ—В–µ–Ї–∞—В—М –Є–Ј –Љ–µ—Б—В–∞ –Ї–Њ–љ—В–∞–Ї—В–∞ —В–≤—С—А–і—Л—Е —В–µ–ї –≤ —В–Њ—З–Ї–Є —Б –љ–∞–Є–Љ–µ–љ—М—И–µ–є –њ–Њ—В–µ–љ—Ж–Є–∞–ї—М–љ–Њ–є —Н–љ–µ—А–≥–Є–µ–є, –Ј–∞–љ–Є–Љ–∞—П –±–Њ–ї–µ–µ –Є–ї–Є –Љ–µ–љ–µ–µ —А–∞–≤–љ–Њ–≤–µ—Б–љ–Њ–µ –њ–Њ–ї–Њ–ґ–µ–љ–Є–µ.
–Ґ–µ–Њ—А–Є—П –Є —В–µ—Е–љ–Є–Ї–∞ –њ—А–Њ—Ж–µ—Б—Б–Њ–≤ –љ–∞ –≥—А–∞–љ–Є—Ж–∞—Е –Љ–∞—В–µ—А–Є–∞–ї–Њ–≤ —Б —А–∞–Ј–ї–Є—З–љ—Л–Љ–Є –≤–µ–ї–Є—З–Є–љ–∞–Љ–Є —Н–Љ–Є—Б—Б–Є–Њ–љ–љ–Њ–є –њ–Њ—Б—В–Њ—П–љ–љ–Њ–є –Є –Ї–Њ–љ—В–∞–Ї—В–љ–∞—П —А–∞–Ј–љ–Њ—Б—В—М –њ–Њ—В–µ–љ—Ж–Є–∞–ї–Њ–≤ –њ–Њ–Ј–≤–Њ–ї—П—О—В —Б–і–µ–ї–∞—В—М –≤—Л–≤–Њ–і, —З—В–Њ –∞–љ—В–Є–Ї–Њ—А—А–Њ–Ј–Є–Њ–љ–љ–∞—П —Г—Б—В–Њ–є—З–Є–≤–Њ—Б—В—М –ґ–µ–ї–µ–Ј–љ–Њ–≥–Њ —Б—В–Њ–ї–±–∞ –Љ–Є–љ–∞—А–µ—В–∞ –Ъ—Г—В—Г–± вАУ –Ь–Є–љ–∞—А –Њ–±—Г—Б–ї–Њ–≤–ї–µ–љ–∞ –і—А–µ–є—Д–Њ–Љ —Н–ї–µ–Ї—В—А–Њ–љ–Њ–≤ –Є–Ј –њ–Њ—З–≤–µ–љ–љ—Л—Е —Б–ї–Њ—С–≤ –њ–Њ–і —Б—В–Њ–ї–±–Њ–Љ (–≥–µ–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е –Ї–∞–Љ–µ–љ–Є—Б—В—Л—Е –њ–Њ—А–Њ–і –Є–ї–Є –Љ–µ–ї–∞, –њ–µ—Б–Ї–∞, –≥–ї–Є–љ, –ї–Є–±–Њ –Є—Е —Б–Љ–µ—Б–µ–є) –≤ —Б—В–Њ–ї–± –Ј–∞ —Б—З—С—В —А–∞–Ј–љ–Є—Ж—Л –≤–µ–ї–Є—З–Є–љ —А–∞–±–Њ—В—Л –≤—Л—Е–Њ–і–∞ —Н–ї–µ–Ї—В—А–Њ–љ–Њ–≤ –Є–Ј –ґ–µ–ї–µ–Ј–∞ –Є –Љ–∞—В–µ—А–Є–∞–ї–Њ–≤ –њ–Њ–і —Б—В–Њ–ї–±–Њ–Љ –Ї–∞–Ї –њ–Њ–Ї–∞–Ј–∞–љ–Њ –љ–∞ —Д–Є–≥—Г—А–µ 1. –Ь–∞—В–µ—А–Є–∞–ї –Ї–∞–ґ–і–Њ–≥–Њ —Б–ї–Њ—П –Є–Љ–µ–µ—В –≤–µ–ї–Є—З–Є–љ—Г —Н–Љ–Є—Б—Б–Є–Њ–љ–љ–Њ–є –њ–Њ—Б—В–Њ—П–љ–љ–Њ–є –Р1, –Р2, –Р3. –Т–µ–ї–Є—З–Є–љ–∞ —Н–Љ–Є—Б—Б–Є–Њ–љ–љ–Њ–є –њ–Њ—Б—В–Њ—П–љ–љ–Њ–є –ґ–µ–ї–µ–Ј–∞ –РFe = 4,36 —Н–Т. –°–Њ–Њ—В–љ–Њ—И–µ–љ–Є–µ –≤–µ–ї–Є—З–Є–љ —Н–Љ–Є—Б—Б–Є–Њ–љ–љ–Њ–є –њ–Њ—Б—В–Њ—П–љ–љ–Њ–є –РFe > –Р1 > –Р2 > –Р3 –Є–ї–Є –РFe > –Р1 > –Р2 = –Р3 –Љ–∞—В–µ—А–Є–∞–ї–Њ–≤ –њ–Њ–і —Б—В–Њ–ї–±–Њ–Љ –Њ–±–µ—Б–њ–µ—З–Є–≤–∞–µ—В –і—А–µ–є—Д —Н–ї–µ–Ї—В—А–Њ–љ–Њ–≤ –≤ —Б—В–Њ–ї–± –Є–Ј –љ–∞—Е–Њ–і—П—Й–Є—Е—Б—П –њ–Њ–і –љ–Є–Љ —Б–ї–Њ—С–≤ вАЩвАЩ—Д—Г–љ–і–∞–Љ–µ–љ—В–∞вАЩвАЩ –Є –њ–Њ–Ј–≤–Њ–ї—П–µ—В –≤–Њ—Б–њ—А–Њ–Є–Ј–≤–Њ–і–Є—В—М —В–µ—Е–љ–Є—З–µ—Б–Ї–Є–Љ–Є —Б—А–µ–і—Б—В–≤–∞–Љ–Є —Н—Д—Д–µ–Ї—В –њ—А–Њ—В–Є–≤–Њ–Ї–Њ—А—А–Њ–Ј–Є–Њ–љ–љ–Њ–є —Г—Б—В–Њ–є—З–Є–≤–Њ—Б—В–Є –ґ–µ–ї–µ–Ј–љ–Њ–≥–Њ —Б—В–Њ–ї–±–∞ –Љ–Є–љ–∞—А–µ—В–∞ –Ъ—Г—В—Г–± вАУ –Ь–Є–љ–∞—А.
–Я–Њ–≤–µ—А—Е–љ–Њ—Б—В–љ—Л–µ –Ј–∞—А—П–і—Л –Є –Ї–Њ–љ—В–∞–Ї—В–љ–∞—П —А–∞–Ј–љ–Њ—Б—В—М –њ–Њ—В–µ–љ—Ж–Є–∞–ї–Њ–≤ (—Д–Є–≥—Г—А—Л 2, 3) –Њ–±—А–∞–Ј—Г—О—В –і–≤–Њ–є–љ–Њ–є —Н–ї–µ–Ї—В—А–Є—З–µ—Б–Ї–Є–є —Б–ї–Њ–є –Ј–∞—А—П–і–Њ–≤. –Т–љ—Г—В—А–Є —Н—В–Њ–≥–Њ —Б–ї–Њ—П —Б—Г—Й–µ—Б—В–≤—Г–µ—В —Н–ї–µ–Ї—В—А–Є—З–µ—Б–Ї–Њ–µ –њ–Њ–ї–µ, —Г—А–∞–≤–љ–Њ–≤–µ—И–Є–≤–∞—О—Й–µ–µ —Б–Є–ї—Г –њ—А–Є—В—П–ґ–µ–љ–Є—П —Н–ї–µ–Ї—В—А–Њ–љ–Њ–≤ –≤ —В–µ–ї–Њ —Б –±–Њ–ї—М—И–µ–є –≤–µ–ї–Є—З–Є–љ–Њ–є —Н–Љ–Є—Б—Б–Є–Њ–љ–љ–Њ–є –њ–Њ—Б—В–Њ—П–љ–љ–Њ–є –Є —Г—Б—В–∞–љ–∞–≤–ї–Є–≤–∞—О—Й–µ–µ —Б–Њ—Б—В–Њ—П–љ–Є–µ —А–∞–≤–љ–Њ–≤–µ—Б–Є—П –Ј–∞—А—П–і–Њ–≤. –Ъ–Њ–љ—В–∞–Ї—В–љ–∞—П —А–∞–Ј–љ–Њ—Б—В—М –њ–Њ—В–µ–љ—Ж–Є–∞–ї–Њ–≤, –Њ–њ—А–µ–і–µ–ї—П–µ–Љ–∞—П —А–∞–Ј–љ–Њ—Б—В—М—О –≤–µ–ї–Є—З–Є–љ —Н–Љ–Є—Б—Б–Є–Њ–љ–љ–Њ–є –њ–Њ—Б—В–Њ—П–љ–љ–Њ–є —Н–ї–µ–Ї—В—А–Њ–љ–Њ–≤, —Б–Њ—Б—В–∞–≤–ї—П–µ—В –і–ї—П –Љ–µ—В–∞–ї–ї–Њ–≤ –Њ—В 0,1–Т –і–Њ 3,0–Т [–Ы3, —Б—В—А. 112]. –Т –ґ–µ–ї–µ–Ј–љ–Њ–Љ —Б—В–Њ–ї–±–µ –Љ–Є–љ–∞—А–µ—В–∞ –Ъ—Г—В—Г–± вАУ –Ь–Є–љ–∞—А —Н–ї–µ–Ї—В—А–Њ–љ—Л –љ–∞–Ї–∞–њ–ї–Є–≤–∞—О—В—Б—П –≤ –Њ—Б–љ–Њ–≤–∞–љ–Є–Є —Б—В–Њ–ї–±–∞ –Є –Ј–∞ —Б—З—С—В –≤–Ј–∞–Є–Љ–љ–Њ–≥–Њ –Њ—В—В–∞–ї–Ї–Є–≤–∞–љ–Є—П, —Н–ї–µ–Ї—В—А–Є—З–µ—Б–Ї–Њ–є –Є —В–µ–њ–ї–Њ–≤–Њ–є —С–Љ–Ї–Њ—Б—В–Є —Б—В–Њ–ї–±–∞ –і—А–µ–є—Д—Г—О—В –≤ –≤–µ—А—Е–љ—О—О –µ–≥–Њ —З–∞—Б—В—М, –і–µ–ї–∞—П –љ–∞ –њ–Њ–≤–µ—А—Е–љ–Њ—Б—В–Є –Є–Ј–±—Л—В–Њ—З–љ—Л–є —Н–ї–µ–Ї—В—А–Њ–љ–љ—Л–є –Ј–∞—А—П–і, –љ–µ–Њ–±—Е–Њ–і–Є–Љ—Л–є –і–ї—П —Б–Њ–Ј–і–∞–љ–Є—П –Ј–∞—Й–Є—В–љ–Њ–≥–Њ —Н–ї–µ–Ї—В—А–Њ—Е–Є–Љ–Є—З–µ—Б–Ї–Њ–≥–Њ –њ–Њ—В–µ–љ—Ж–Є–∞–ї–∞, –њ—А–Є –Ї–Њ—В–Њ—А–Њ–Љ –Њ—Б—Г—Й–µ—Б—В–≤–ї—П–µ—В—Б—П –њ–Њ–ї–љ–∞—П —Н–ї–µ–Ї—В—А–Њ—Е–Є–Љ–Є—З–µ—Б–Ї–∞—П –Ј–∞—Й–Є—В–∞ –ґ–µ–ї–µ–Ј–∞ –њ—А–Є –Є—Б–њ–∞—А–µ–љ–Є–Є –Њ—В–і–µ–ї—М–љ—Л—Е –Ї–∞–њ–µ–ї—М –∞—В–Љ–Њ—Б—Д–µ—А–љ–Њ–є –≤–ї–∞–≥–Є. –Т –Љ–∞—В–µ—А–Є–∞–ї–µ –њ–Њ–і –Њ—Б–љ–Њ–≤–∞–љ–Є–µ–Љ —Б—В–Њ–ї–±–∞ –њ–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ—Л–µ –Ј–∞—А—П–і—Л –і—А–µ–є—Д—Г—О—В –≤–≥–ї—Г–±—М –Ј–µ–Љ–ї–Є –Ј–∞ —Б—З–µ—В —Б–Є–ї –Њ—В—В–∞–ї–Ї–Є–≤–∞–љ–Є—П –Њ–і–љ–Њ–Є–Љ–µ–љ–љ—Л—Е –Ј–∞—А—П–і–Њ–≤ –і–Њ –≥—А–∞–љ–Є—Ж—Л –Љ–∞—В–µ—А–Є–∞–ї–Њ–≤ –Р1вАУ–Р2. –Ч–і–µ—Б—М –≤ —Б–≤–Њ—О –Њ—З–µ—А–µ–і—М —Б—Г—Й–µ—Б—В–≤—Г–µ—В –і–≤–Њ–є–љ–Њ–є —Н–ї–µ–Ї—В—А–Є—З–µ—Б–Ї–Є–є —Б–ї–Њ–є (—Д–Є–≥—Г—А–∞ 1) –Ј–∞ —Б—З–µ—В —А–∞–Ј–љ–Є—Ж—Л –≤–µ–ї–Є—З–Є–љ —Н–Љ–Є—Б—Б–Є–Њ–љ–љ–Њ–є –њ–Њ—Б—В–Њ—П–љ–љ–Њ–є –Љ–∞—В–µ—А–Є–∞–ї–Њ–≤ –Р1 –Є –Р2, –Ї –Ї–Њ–ї–Њ–љ–љ–µ –Њ–±—А–∞—Й–µ–љ—Л –Њ—В—А–Є—Ж–∞—В–µ–ї—М–љ—Л–µ –Ј–∞—А—П–і—Л, –≤–≥–ї—Г–±—М –Ј–µ–Љ–ї–Є вАУ –њ–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ—Л–µ, –Њ–љ–Є —А–∞—Б—Е–Њ–і—П—В—Б—П –Ј–∞ —Б—З–µ—В —Б–Є–ї –≤–Ј–∞–Є–Љ–љ–Њ–≥–Њ –Њ—В—В–∞–ї–Ї–Є–≤–∞–љ–Є—П –і–Њ –≥—А–∞–љ–Є—Ж—Л –Љ–∞—В–µ—А–Є–∞–ї–Њ–≤ –Р2вАУ–Р3. –Ю—В—А–Є—Ж–∞—В–µ–ї—М–љ—Л–µ –Ј–∞—А—П–і—Л –љ–∞ –≥—А–∞–љ–Є—Ж–µ –Р1вАУ–Р2 —А–µ–∞–≥–Є—А—Г—О—В —Б –њ—А–Є—И–µ–і—И–Є–Љ–Є –Њ—В –≥—А–∞–љ–Є—Ж—Л –РFe вАУ–Р1 –њ–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ—Л–Љ–Є –Ј–∞—А—П–і–∞–Љ–Є, –≤–Ј–∞–Є–Љ–љ–Њ –Ї–Њ–Љ–њ–µ–љ—Б–Є—А—Г—П, —В–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ —Б –≥—А–∞–љ–Є—Ж—Л –Р1вАУ–Р2 —А–∞—Б—В–µ–Ї–∞—О—В—Б—П –Ј–∞—А—П–і—Л –Є –њ—А–Њ–і–Њ–ї–ґ–∞–µ—В—Б—П —А–µ–∞–Ї—Ж–Є—П —А–∞–Ј–і–µ–ї–µ–љ–Є—П –Ј–∞—А—П–і–Њ–≤ –њ–Њ —Б—Е–µ–Љ–∞–Љ –љ–∞ —Д–Є–≥—Г—А–∞—Е 2 –Є 3. –Р–љ–∞–ї–Њ–≥–Є—З–љ—Л–є –њ—А–Њ—Ж–µ—Б—Б —А–∞–Ј–і–µ–ї–µ–љ–Є—П –Ј–∞—А—П–і–Њ–≤ –Є —А–µ–∞–Ї—Ж–Є—П –Є—Е –Ї–Њ–Љ–њ–µ–љ—Б–∞—Ж–Є–Є –њ—А–Њ–Є—Б—Е–Њ–і–Є—В –љ–∞ –≥—А–∞–љ–Є—Ж–µ –Љ–∞—В–µ—А–Є–∞–ї–Њ–≤ –Р2вАУ–Р3.
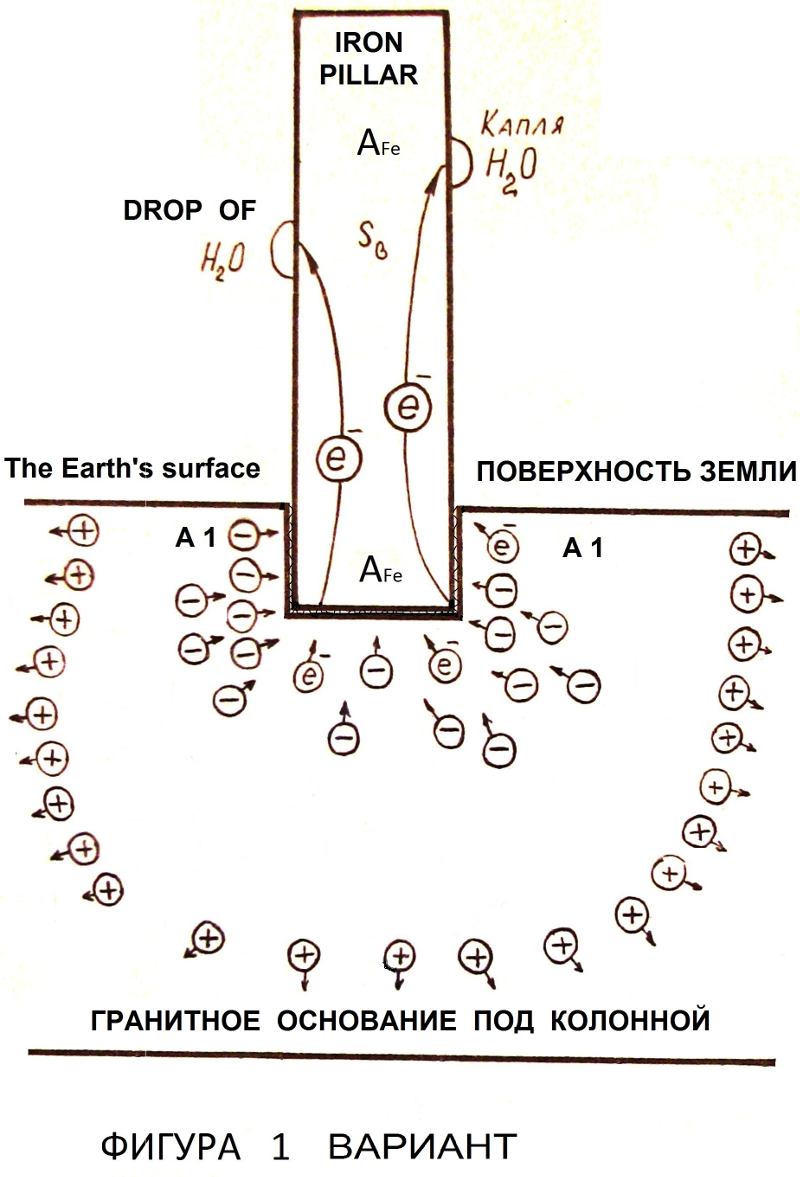
–Т –≥—А–∞–љ–Є—В–µ, –љ–µ–Ї–Њ—В–Њ—А—Л—Е –і—А—Г–≥–Є—Е –Ї–∞–Љ–µ–љ–Є—Б—В—Л—Е –њ–Њ—А–Њ–і–∞—Е –њ—А–Є —Б—Г—В–Њ—З–љ—Л—Е –Ї–Њ–ї–µ–±–∞–љ–Є—П—Е —В–µ–Љ–њ–µ—А–∞—В—Г—А—Л –Є –і–∞–≤–ї–µ–љ–Є—П –≤–Њ–Ј–љ–Є–Ї–∞–µ—В –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є—П —Н–ї–µ–Ї—В—А–Њ–љ–Њ–≤ –≤ –Њ–њ—А–µ–і–µ–ї—С–љ–љ—Л—Е —З–∞—Б—В—П—Е –Њ–±—К—С–Љ–∞. –Х—Б–ї–Є —Б—В–Њ–ї–± —Г—Б—В–∞–љ–Њ–≤–ї–µ–љ –љ–∞ –≥—А–∞–љ–Є—В–љ–Њ–Љ –Њ—Б–љ–Њ–≤–∞–љ–Є–Є (—Д–Є–≥—Г—А–∞ 1, –≤–∞—А–Є–∞–љ—В), —В–Њ –Њ–љ–Њ –Є–≥—А–∞–µ—В —А–Њ–ї—М —Н–Љ–Є—В—В–µ—А–∞ —Н–ї–µ–Ї—В—А–Њ–љ–Њ–≤ –≤ —Б—В–Њ–ї–±.
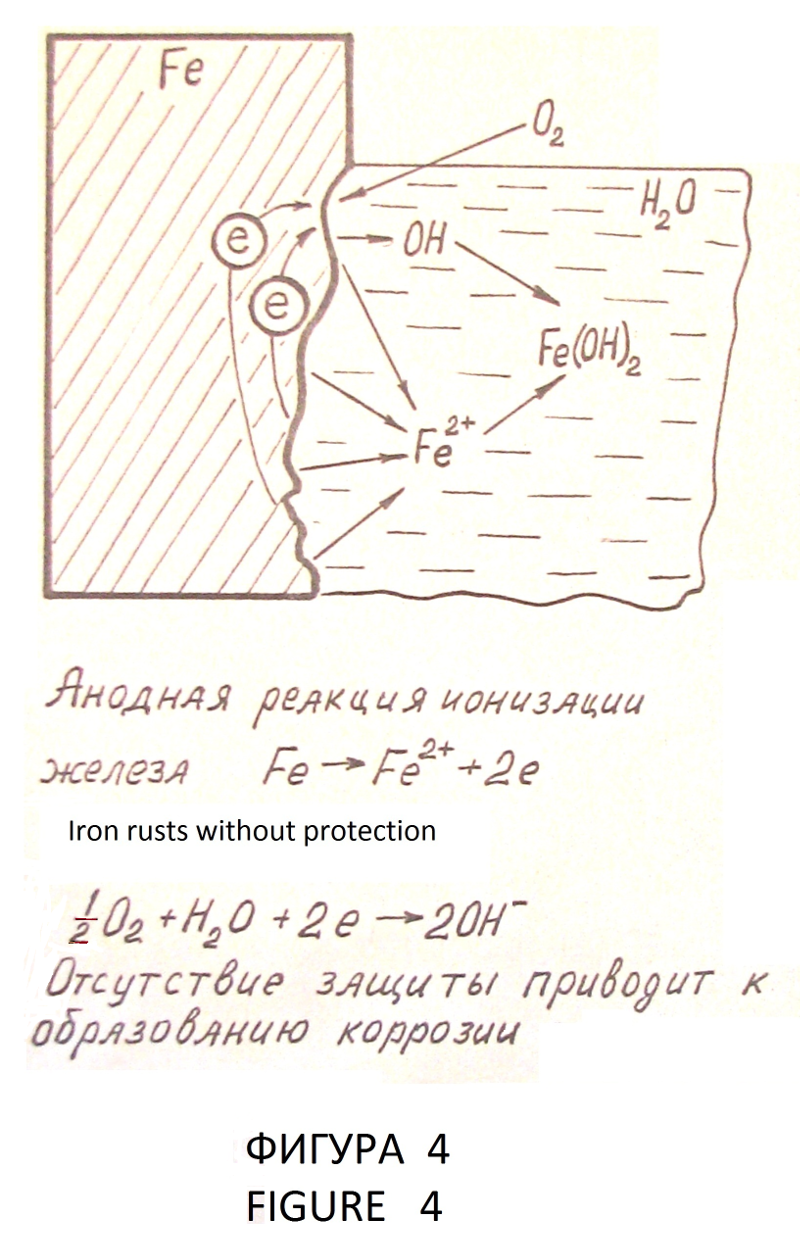
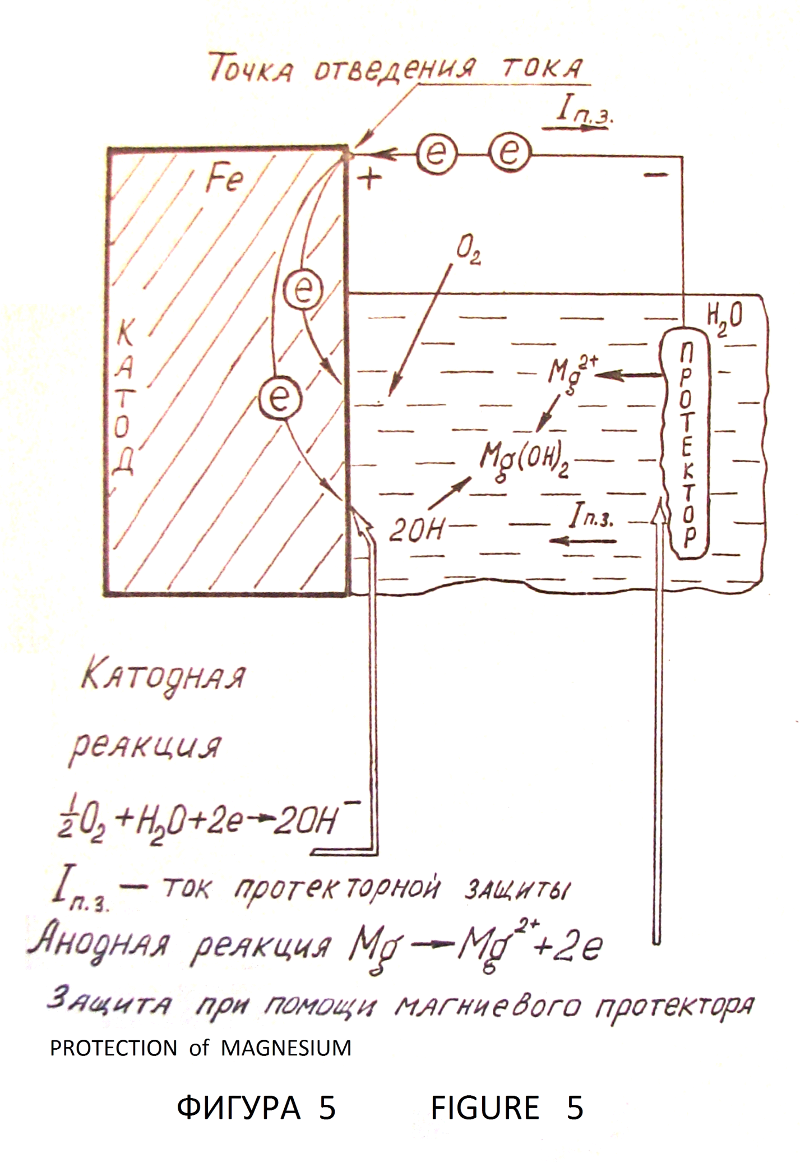
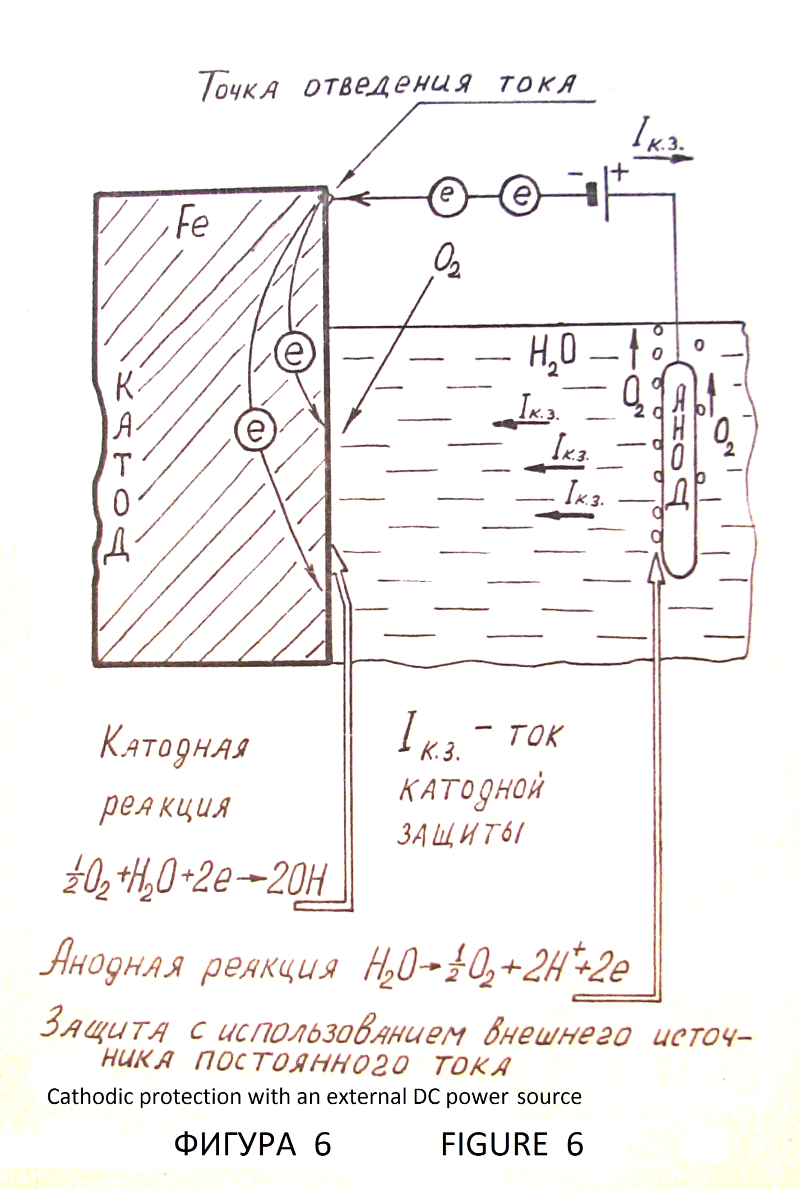
–С–µ–Ј –Ј–∞—Й–Є—В—Л –ґ–µ–ї–µ–Ј–Њ —А–ґ–∞–≤–µ–µ—В –≤ –≤–Њ–і–µ (—Д–Є–≥—Г—А–∞ 4). –≠–ї–µ–Ї—В—А–Њ—Е–Є–Љ–Є—З–µ—Б–Ї–∞—П –Ј–∞—Й–Є—В–∞ –Љ–µ—В–∞–ї–ї–Њ–≤ –Њ—В –Ї–Њ—А—А–Њ–Ј–Є–Є –Њ—Б–љ–Њ–≤–∞–љ–∞ –љ–∞ –Ї–∞—В–Њ–і–љ–Њ–є –њ–Њ–ї—П—А–Є–Ј–∞—Ж–Є–Є –Љ–µ—В–∞–ї–ї–∞ –і–Њ –њ–Њ—В–µ–љ—Ж–Є–∞–ї–∞, –њ—А–Є –Ї–Њ—В–Њ—А–Њ–Љ –њ—А–µ–Ї—А–∞—Й–∞–µ—В—Б—П –њ—А–Њ—Ж–µ—Б—Б –Є–Њ–љ–Є–Ј–∞—Ж–Є–Є –Љ–Њ–ї–µ–Ї—Г–ї –Љ–µ—В–∞–ї–ї–∞. –Ш—Б—В–Њ—З–љ–Є–Ї–Њ–Љ –њ–Њ–ї—П—А–Є–Ј—Г—О—Й–µ–≥–Њ —В–Њ–Ї–∞ –Љ–Њ–ґ–µ—В –±—Л—В—М –≥–∞–ї—М–≤–∞–љ–Є—З–µ—Б–Ї–Є–є —Н–ї–µ–Љ–µ–љ—В. –Ч–∞—Й–Є—Й–∞–µ–Љ–∞—П –ґ–µ–ї–µ–Ј–љ–∞—П –Ї–Њ–љ—Б—В—А—Г–Ї—Ж–Є—П —П–≤–ї—П–µ—В—Б—П –Ї–∞—В–Њ–і–Њ–Љ. –≠–ї–µ–Ї—В—А–Њ–і —Б –њ–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ—Л–Љ –њ–Њ—В–µ–љ—Ж–Є–∞–ї–Њ–Љ вАУ –њ—А–Њ—В–µ–Ї—В–Њ—А —А–∞–Ј—А—Г—И–∞–µ—В—Б—П –≤ –њ—А–Њ—Ж–µ—Б—Б–µ –Ј–∞—Й–Є—В—Л (—Д–Є–≥—Г—А–∞ 5). –°—Г—Й–µ—Б—В–≤—Г–µ—В –≤–∞—А–Є–∞–љ—В —Н–ї–µ–Ї—В—А–Њ—Е–Є–Љ–Є—З–µ—Б–Ї–Њ–є –Ј–∞—Й–Є—В—Л —Б –≤–љ–µ—И–љ–Є–Љ –Є—Б—В–Њ—З–љ–Є–Ї–Њ–Љ –њ–Њ—Б—В–Њ—П–љ–љ–Њ–≥–Њ —В–Њ–Ї–∞ –±–µ–Ј —А–∞–Ј—А—Г—И–µ–љ–Є—П –∞–љ–Њ–і–∞ вАУ –њ—А–Њ—В–µ–Ї—В–Њ—А–∞ (—Д–Є–≥—Г—А–∞ 6). –Ь–µ—В–∞–ї–ї –њ—А–Є —Н—В–Њ–Љ –њ—А–∞–Ї—В–Є—З–µ—Б–Ї–Є –љ–µ –Ї–Њ—А—А–Њ–Ј–Є—А—Г–µ—В, —В–Њ –µ—Б—В—М –љ–∞—Е–Њ–і–Є—В—Б—П –њ–Њ–і –њ–Њ–ї–љ–Њ–є –Ї–∞—В–Њ–і–љ–Њ–є –Ј–∞—Й–Є—В–Њ–є. –Я–Њ—В–µ–љ—Ж–Є–∞–ї, –њ—А–Є –Ї–Њ—В–Њ—А–Њ–Љ –Њ—Б—Г—Й–µ—Б—В–≤–ї—П–µ—В—Б—П –њ–Њ–ї–љ–∞—П –Ј–∞—Й–Є—В–∞ –Љ–µ—В–∞–ї–ї–∞, –љ–∞–Ј—Л–≤–∞–µ—В—Б—П –Ј–∞—Й–Є—В–љ—Л–Љ –њ–Њ—В–µ–љ—Ж–Є–∞–ї–Њ–Љ, –∞ —В–Њ–Ї вАУ –Ј–∞—Й–Є—В–љ—Л–Љ —В–Њ–Ї–Њ–Љ. –Ю–±—П–Ј–∞—В–µ–ї—М–љ–Њ–µ —Г—Б–ї–Њ–≤–Є–µ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є—П –њ—А–Њ—В–µ–Ї—В–Њ—А–љ–Њ–є –Ї–∞—В–Њ–і–љ–Њ–є –Ј–∞—Й–Є—В—Л вАУ –њ—А–Є—Б—Г—В—Б—В–≤–Є–µ —В–Њ–Ї–Њ–њ—А–Њ–≤–Њ–і—П—Й–µ–є –Ї–Њ—А—А–Њ–Ј–Є–Њ–љ–љ–Њ вАУ –∞–Ї—В–Є–≤–љ–Њ–є —Б—А–µ–і—Л (–≤–Њ–і–∞, –≤–ї–∞–ґ–љ–∞—П –њ–Њ—З–≤–∞ –Є —В–Њ–Љ—Г –њ–Њ–і–Њ–±–љ—Л–µ —Б—А–µ–і—Л) –і–ї—П –Ј–∞–Љ—Л–Ї–∞–љ–Є—П –Ј–∞—Й–Є—В–љ–Њ–≥–Њ —В–Њ–Ї–∞, –њ—А–Є—З–µ–Љ –љ–µ–Њ–±—Е–Њ–і–Є–Љ–∞ –Љ–∞–Ї—Б–Є–Љ–∞–ї—М–љ–∞—П —А–∞–≤–љ–Њ–Љ–µ—А–љ–Њ—Б—В—М —А–∞—Б–њ—А–µ–і–µ–ї–µ–љ–Є—П —В–Њ–Ї–∞ –њ–Њ –≤—Б–µ–є –њ–Њ–≤–µ—А—Е–љ–Њ—Б—В–Є –Ј–∞—Й–Є—Й–∞–µ–Љ–Њ–є –Ї–Њ–љ—Б—В—А—Г–Ї—Ж–Є–Є. –Ъ—А–Є—В–µ—А–Є—П–Љ–Є –њ—А–Њ—В–µ–Ї—В–Њ—А–љ–Њ–є –Є –Ї–∞—В–Њ–і–љ–Њ–є –Ј–∞—Й–Є—В—Л —П–≤–ї—П—О—В—Б—П —Н–ї–µ–Ї—В—А–Є—З–µ—Б–Ї–Є–µ –≤–µ–ї–Є—З–Є–љ—Л: –Ј–∞—Й–Є—В–љ—Л–є –њ–Њ—В–µ–љ—Ж–Є–∞–ї –Є –Ј–∞—Й–Є—В–љ–∞—П –њ–ї–Њ—В–љ–Њ—Б—В—М —В–Њ–Ї–∞. –Я–Њ—В–µ–љ—Ж–Є–∞–ї —Б—В–∞–ї–Є –≤ –њ—А–Є—А–Њ–і–љ—Л—Е –Ї–Њ—А—А–Њ–Ј–Є–Њ–љ–љ–Њ вАУ –∞–Ї—В–Є–≤–љ—Л—Е —Б—А–µ–і–∞—Е –≤ —Б—А–µ–і–љ–µ–Љ —Б–Њ—Б—В–∞–≤–ї—П–µ—В вАУ 0,55 –Т –Њ—В–љ–Њ—Б–Є—В–µ–ї—М–љ–Њ –Љ–µ–і–љ–Њ—Б—Г–ї—М—Д–∞—В–љ–Њ–≥–Њ —Н–ї–µ–Ї—В—А–Њ–і–∞. –Я–Њ–ї—П—А–Є–Ј–∞—Ж–Є—П —Б—В–∞–ї—М–љ—Л—Е –Ї–Њ–љ—Б—В—А—Г–Ї—Ж–Є–є –і–Њ –Ј–∞—Й–Є—В–љ–Њ–≥–Њ –њ–Њ—В–µ–љ—Ж–Є–∞–ї–∞ вАУ 0,85 –Т–Њ–ї—М—В–∞ –Њ—В–љ–Њ—Б–Є—В–µ–ї—М–љ–Њ —В–Њ–≥–Њ –ґ–µ —Н–ї–µ–Ї—В—А–Њ–і–∞ –Є –µ–≥–Њ –њ–Њ–і–і–µ—А–ґ–∞–љ–Є–µ –Њ–±–µ—Б–њ–µ—З–Є–≤–∞—О—В –њ–Њ–ї–љ—Г—О –Ї–∞—В–Њ–і–љ—Г—О –Ј–∞—Й–Є—В—Г. –≠—В–Њ—В –њ–∞—А–∞–Љ–µ—В—А —Г—Б—В–∞–љ–Њ–≤–ї–µ–љ –≤ 1928 –≥–Њ–і—Г, –њ–Њ–і—В–≤–µ—А–ґ–і–µ–љ –≤ –і–∞–ї—М–љ–µ–є—И–µ–Љ –Љ–љ–Њ–≥–Њ–ї–µ—В–љ–µ–є –њ—А–∞–Ї—В–Є–Ї–Њ–є –Є –≤ –љ–∞—Б—В–Њ—П—Й–µ–µ –≤—А–µ–Љ—П —П–≤–ї—П–µ—В—Б—П –њ—А–Є–љ—П—В—Л–Љ –Ї—А–Є—В–µ—А–Є–µ–Љ –Ї–∞—В–Њ–і–љ–Њ–є –Ј–∞—Й–Є—В—Л —Б—В–∞–ї–Є. –Я—А–∞–≤–Є–ї—М–љ–Њ —Б–њ—А–Њ–µ–Ї—В–Є—А–Њ–≤–∞–љ–љ–∞—П –Є –Є—Б–њ—А–∞–≤–љ–∞—П —Б–Є—Б—В–µ–Љ–∞ —Н–ї–µ–Ї—В—А–Њ—Е–Є–Љ–Є—З–µ—Б–Ї–Њ–є –Ј–∞—Й–Є—В—Л –Њ–±–µ—Б–њ–µ—З–Є–≤–∞–µ—В 100% –Ј–∞–Љ–µ–і–ї–µ–љ–Є–µ –Ї–Њ—А—А–Њ–Ј–Є–Њ–љ–љ—Л—Е –њ—А–Њ—Ж–µ—Б—Б–Њ–≤ [–Ы5 —Б—В—А. 139 вАУ 143].
–Ф–ї—П –Њ—Б—Г—Й–µ—Б—В–≤–ї–µ–љ–Є—П –Ј–∞—Й–Є—В—Л —В—А–µ–±—Г–µ—В—Б—П –≤—Л–њ–Њ–ї–љ–µ–љ–Є—П —Г—Б–ї–Њ–≤–Є–є:
- –Р) –Ї–Њ–љ—Б—В—А—Г–Ї—Ж–Є—П –љ–µ –і–Њ–ї–ґ–љ–∞ –Є–Љ–µ—В—М —Б–ї–Є—И–Ї–Њ–Љ —Б–ї–Њ–ґ–љ—Г—О —Д–Њ—А–Љ—Г;
- –С) –љ–∞ –≤—Б–µ–Љ –њ—А–Њ—В—П–ґ–µ–љ–Є–Є –Ї–Њ–љ—Б—В—А—Г–Ї—Ж–Є–Є –љ–µ –і–Њ–ї–ґ–љ–Њ –±—Л—В—М —А–∞–Ј—А—Л–≤–Њ–≤ —Н–ї–µ–Ї—В—А–Є—З–µ—Б–Ї–Њ–є —Ж–µ–њ–Є.
–Ґ—А–∞–і–Є—Ж–Є–Њ–љ–љ—Л–µ —Б–Є—Б—В–µ–Љ—Л —Н–ї–µ–Ї—В—А–Њ—Е–Є–Љ–Є—З–µ—Б–Ї–Њ–є –Ј–∞—Й–Є—В—Л –Љ–µ—В–∞–ї–ї–Њ–≤ –Њ—В –Ї–Њ—А—А–Њ–Ј–Є–Є –љ–µ—Ж–µ–ї–µ—Б–Њ–Њ–±—А–∞–Ј–љ–Њ –њ—А–Є–Љ–µ–љ—П—В—М –≤ —Б–ї—Г—З–∞—П—Е –≤–Њ–Ј–і–µ–є—Б—В–≤–Є—П –∞—В–Љ–Њ—Б—Д–µ—А–љ–Њ–є –≤–ї–∞–≥–Є –Є–Ј вАУ –Ј–∞ –Є—Е –љ–Є–Ј–Ї–Њ–є —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є [–Ы5, —Б—В—А. 141], —В–∞–Ї –Ї–∞–Ї –Ї–∞–њ–ї–Є –∞—В–Љ–Њ—Б—Д–µ—А–љ–Њ–є –≤–ї–∞–≥–Є –Є–Ј–Њ–ї–Є—А–Њ–≤–∞–љ—Л –Њ—В —Н–ї–µ–Ї—В—А–Є—З–µ—Б–Ї–Њ–є —Ж–µ–њ–Є. –Ю–і–љ–Њ–≤—А–µ–Љ–µ–љ–љ–Њ —Б—Г—Й–µ—Б—В–≤—Г–µ—В –њ—А–Є–Љ–µ—А –њ—А–Њ—В–Є–≤–Њ–Ї–Њ—А—А–Њ–Ј–Є–Њ–љ–љ–Њ–є —Г—Б—В–Њ–є—З–Є–≤–Њ—Б—В–Є –ґ–µ–ї–µ–Ј–љ–Њ–≥–Њ —Б—В–Њ–ї–±–∞ –Ъ—Г—В—Г–± вАУ –Ь–Є–љ–∞—А, –Ї–Њ—В–Њ—А—Л–є —П–≤–ї—П–µ—В—Б—П –Є–љ–і—Г—Ж–Є—А–Њ–≤–∞–љ–љ—Л–Љ –Ї–∞—В–Њ–і–Њ–Љ –±–µ–Ј —В—А–∞–і–Є—Ж–Є–Њ–љ–љ–Њ–≥–Њ –∞–љ–Њ–і–∞ вАУ –њ—А–Њ—В–µ–Ї—В–Њ—А–∞. –С–Њ—А–Є—Б –†–µ–≤–∞—И–Є–љ, 22 —Б–µ–љ—В—П–±—А—П 2015–≥.
–Ы –Ш –Ґ –Х –† –Р –Ґ –£ –† –Р :
- –Ц—Г–Ї–Њ–≤ –Р.–Я., –Ь–∞–ї–∞—Е–Њ–≤ –Р.–Ш. вАЭ–Ю—Б–љ–Њ–≤—Л –Љ–µ—В–∞–ї–ї–Њ–≤–µ–і–µ–љ–Є—П –Є —В–µ–Њ—А–Є–Є –Ї–Њ—А—А–Њ–Ј–Є–ЄвАЭ –Ь., 1991 –≥.
- –С—Н–Ї–Љ–∞–љ –Т., –®–≤–µ–љ–Ї –Т. вАЬ–Ъ–∞—В–Њ–і–љ–∞—П –Ј–∞—Й–Є—В–∞ –Њ—В –Ї–Њ—А—А–Њ–Ј–Є–ЄвАЭ –Ь., 1984 –≥.
- –Ґ—Н–љ—Н—Б—Н—Б–Ї—Г –§., –Ъ—А–∞–Љ–∞—А—О–Ї –†. вАЬ–≠–ї–µ–Ї—В—А–Њ—Б—В–∞—В–Є–Ї–∞ –≤ —В–µ—Е–љ–Є–Ї–µвАЭ –Ь., вАЬ–≠–љ–µ—А–≥–Є—ПвАЭ, 1980 –≥.
- –Ъ–Њ—И–Ї–Є–љ –Э. –Є –і—А.,вАЬ–°–њ—А–∞–≤–Њ—З–љ–Є–Ї –њ–Њ —Н–ї–µ–Љ–µ–љ—В–∞—А–љ–Њ–є —Д–Є–Ј–Є–Ї–µвАЭ –Ь., вАЬ–Э–∞—Г–Ї–∞вАЭ, 1988–≥.
- –Ѓ—Е–љ–µ–≤–Є—З –†. –Є –і—А., вАЬ–Ґ–µ—Е–љ–Є–Ї–∞ –±–Њ—А—М–±—Л —Б –Ї–Њ—А—А–Њ–Ј–Є–µ–є вАЭ –Ы., вАЬ–•–Є–Љ–Є—ПвАЭ, 1980–≥.
- –Т–Њ—А–Њ–љ–Ї–Њ–≤ –У.–ѓ. вАЬ–≠–ї–µ–Ї—В—А–Є—З–µ—Б—В–≤–Њ –≤ –Љ–Є—А–µ —Е–Є–Љ–Є–ЄвАЭ –Ь., 1987 –≥.