–°—А–Њ—З–љ–∞—П –њ—Г–±–ї–Є–Ї–∞—Ж–Є—П –љ–∞—Г—З–љ–Њ–є —Б—В–∞—В—М–Є
+7 995 770 98 40
+7 995 202 54 42
info@journalpro.ru
–°–∞–Љ–Њ—А–∞—Б–њ—А–Њ—Б—В—А–∞–љ—П—О—Й–Є–є—Б—П –≤—Л—Б–Њ–Ї–Њ—В–µ–Љ–њ–µ—А–∞—В—Г—А–љ—Л–є —Б–Є–љ—В–µ–Ј –љ–Є—В—А–Є–і–љ–Њ–є –Ї–Њ–Љ–њ–Њ–Ј–Є—Ж–Є–Є TiN-BN —Б –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ–Љ –∞–Ј–Є–і–∞ –љ–∞—В—А–Є—П
–†—Г–±—А–Є–Ї–∞: –Ґ–µ—Е–љ–Є—З–µ—Б–Ї–Є–µ –љ–∞—Г–Ї–Є
–Ц—Г—А–љ–∞–ї: « –Х–≤—А–∞–Ј–Є–є—Б–Ї–Є–є –Э–∞—Г—З–љ—Л–є –Ц—Г—А–љ–∞–ї вДЦ10 2016» (–Њ–Ї—В—П–±—А—М)
–Ъ–Њ–ї–Є—З–µ—Б—В–≤–Њ –њ—А–Њ—Б–Љ–Њ—В—А–Њ–≤ —Б—В–∞—В—М–Є: 2534
–Я–Њ–Ї–∞–Ј–∞—В—М PDF –≤–µ—А—Б–Є—О –°–∞–Љ–Њ—А–∞—Б–њ—А–Њ—Б—В—А–∞–љ—П—О—Й–Є–є—Б—П –≤—Л—Б–Њ–Ї–Њ—В–µ–Љ–њ–µ—А–∞—В—Г—А–љ—Л–є —Б–Є–љ—В–µ–Ј –љ–Є—В—А–Є–і–љ–Њ–є –Ї–Њ–Љ–њ–Њ–Ј–Є—Ж–Є–Є TiN-BN —Б –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ–Љ –∞–Ј–Є–і–∞ –љ–∞—В—А–Є—П
–Ъ–µ—А—Б–Њ–љ –Ш—А–Є–љ–∞ –Р–ї–µ–Ї—Б–∞–љ–і—А–Њ–≤–љ–∞
–∞—Б–њ–Є—А–∞–љ—В –§–У–С–Ю–£ –Т–Ю ¬Ђ–°–∞–Љ–∞—А—Б–Ї–Є–є –≥–Њ—Б—Г–і–∞—А—Б—В–≤–µ–љ–љ—Л–є
—В–µ—Е–љ–Є—З–µ—Б–Ї–Є–є —Г–љ–Є–≤–µ—А—Б–Є—В–µ—В¬ї
–Ъ–Њ–љ–і—А–∞—В—М–µ–≤–∞ –Ы—О–і–Љ–Є–ї–∞ –Р–ї–µ–Ї—Б–∞–љ–і—А–Њ–≤–љ–∞
–Ї–∞–љ–і–Є–і–∞—В —В–µ—Е–љ–Є—З–µ—Б–Ї–Є—Е –љ–∞—Г–Ї,
–і–Њ—Ж–µ–љ—В –Ї–∞—Д–µ–і—А—Л ¬Ђ–Ь–µ—В–∞–ї–ї–Њ–≤–µ–і–µ–љ–Є–µ,
–њ–Њ—А–Њ—И–Ї–Њ–≤–∞—П –Љ–µ—В–∞–ї–ї—Г—А–≥–Є—П, –љ–∞–љ–Њ–Љ–∞—В–µ—А–∞–ї—Л¬ї
–§–У–С–Ю–£ –Т–Ю ¬Ђ–°–∞–Љ–∞—А—Б–Ї–Є–є –≥–Њ—Б—Г–і–∞—А—Б—В–≤–µ–љ–љ—Л–є —В–µ—Е–љ–Є—З–µ—Б–Ї–Є–є —Г–љ–Є–≤–µ—А—Б–Є—В–µ—В¬ї
E-mail: schiglou@yandex.ru
–¶–µ–ї—М—О —А–∞–±–Њ—В—Л —П–≤–ї—П–ї–Њ—Б—М –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –Ј–∞–≤–Є—Б–Є–Љ–Њ—Б—В–µ–є –≤—Л—Е–Њ–і–љ—Л—Е –њ–∞—А–∞–Љ–µ—В—А–Њ–≤ –≥–Њ—А–µ–љ–Є—П (—В–µ–Љ–њ–µ—А–∞—В—Г—А—Л –Є —Б–Ї–Њ—А–Њ—Б—В–Є –≥–Њ—А–µ–љ–Є—П) –Є —Б–Є–љ—В–µ–Ј–∞ (—А–∞–Ј–Љ–µ—А –Є –Љ–Њ—А—Д–Њ–ї–Њ–≥–Є—П —З–∞—Б—В–Є—Ж) –њ—А–Є —А–∞–Ј–љ–Њ–Љ –Ї–Њ–ї–Є—З–µ—Б—В–≤–µ —Е –Є —Г –≤ —Б–Є—Б—В–µ–Љ–µ ¬Ђ—ЕNaBF4-NaN3-—ГNa2TiF6¬ї.
–†–µ–Ј—Г–ї—М—В–∞—В—Л –Ј–∞–≤–Є—Б–Є–Љ–Њ—Б—В–µ–є —В–µ–Љ–њ–µ—А–∞—В—Г—А—Л –Є —Б–Ї–Њ—А–Њ—Б—В–Є –≥–Њ—А–µ–љ–Є—П –Њ—В —Б–Њ–Њ—В–љ–Њ—И–µ–љ–Є—П –Ї–Њ–Љ–њ–Њ–љ–µ–љ—В–Њ–≤ –≤ —Б–Є—Б—В–µ–Љ–µ ¬Ђ—ЕNaBF4-NaN3-—ГNa2TiF6¬ї, –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ—Л –љ–∞ —А–Є—Б—Г–љ–Ї–µ 1.
–Ш–Ј –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ–љ—Л—Е –љ–∞ —А–Є—Б—Г–љ–Ї–µ 1 –Ј–∞–≤–Є—Б–Є–Љ–Њ—Б—В–µ–є –≤–Є–і–љ–Њ, —З—В–Њ —Б —Г–≤–µ–ї–Є—З–µ–љ–Є–µ–Љ —Б–Њ–і–µ—А–ґ–∞–љ–Є—П NaBF4 –≤ —Б–Љ–µ—Б–Є ¬ЂNaBF4+NaN3+Na2TiF6¬ї, —Б–Ї–Њ—А–Њ—Б—В—М –Є —В–µ–Љ–њ–µ—А–∞—В—Г—А–∞ –≥–Њ—А–µ–љ–Є—П —Б–љ–Є–ґ–∞—О—В—Б—П, –∞ —Б —Г–≤–µ–ї–Є—З–µ–љ–Є–µ–Љ —Б–Њ–і–µ—А–ґ–∞–љ–Є—П Na2TiF6 –≤ —Б–Љ–µ—Б–Є ¬ЂNaBF4+NaN3+Na2TiF6¬ї, —В–µ–Љ–њ–µ—А–∞—В—Г—А–∞ –≥–Њ—А–µ–љ–Є—П —А–∞—Б—В–µ—В, —Б–Ї–Њ—А–Њ—Б—В—М –≥–Њ—А–µ–љ–Є—П –њ–Њ—Б—В–Њ—П–љ–љ–∞.
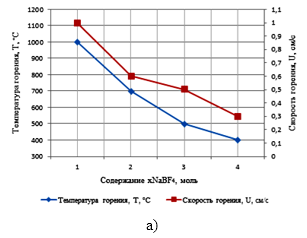
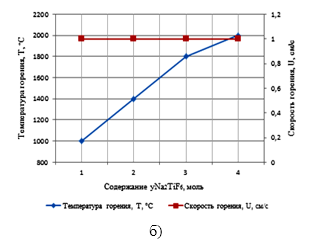
–†–Є—Б—Г–љ–Њ–Ї 1. –Ч–∞–≤–Є—Б–Є–Љ–Њ—Б—В—М —В–µ–Љ–њ–µ—А–∞—В—Г—А—Л –Є —Б–Ї–Њ—А–Њ—Б—В–Є –≥–Њ—А–µ–љ–Є—П
–Њ—В —Б–Њ–Њ—В–љ–Њ—И–µ–љ–Є—П –Ї–Њ–Љ–њ–Њ–љ–µ–љ—В–Њ–≤ –≤ —Б–Є—Б—В–µ–Љ–µ ¬Ђ—ЕNaBF4-NaN3-—ГNa2TiF6¬ї:
–∞) –њ—А–Є —ЕNaBF4 = 1,2,3,4 –Љ–Њ–ї—М; –±) –њ—А–Є —ГNa2TiF6 = 1,2,3,4 –Љ–Њ–ї—М
–†–µ–љ—В–≥–µ–љ–Њ—Д–∞–Ј–Њ–≤—Л–є –∞–љ–∞–ї–Є–Ј (–†–§–Р) –Ї–Њ–љ–µ—З–љ–Њ–≥–Њ –њ—А–Њ–Љ—Л—В–Њ–≥–Њ –њ—А–Њ–і—Г–Ї—В–∞ –≥–Њ—А–µ–љ–Є—П –њ—А–Њ–≤–Њ–і–Є–ї–Є —Б –њ–Њ–Љ–Њ—Й—М—О –і–Є—Д—А–∞–Ї—В–Њ–Љ–µ—В—А–∞ ARL X'trA-138. –†–µ–Ј—Г–ї—М—В–∞—В—Л –†–§–Р (—А–Є—Б—Г–љ–Њ–Ї 2) –њ–Њ–Ї–∞–Ј–∞–ї–Є, —З—В–Њ –Ї–Њ–љ–µ—З–љ—Л–є –њ—А–Њ–Љ—Л—В—Л–є –њ—А–Њ–і—Г–Ї—В —Б–Њ—Б—В–Њ–Є—В –Є–Ј —Д–∞–Ј: TiN, BN, Ti –Є Na3TiF6, –њ—А–Є —Б–ї–µ–і—Г—О—Й–µ–Љ —Б–Њ–Њ—В–љ–Њ—И–µ–љ–Є–Є:
- –њ—А–Є —ЕNaBF4= 1 –Љ–Њ–ї—М –Є —ГNa2TiF6 = 1 –Љ–Њ–ї—М: TiN = 82 %, BN = 9 %, Na3TiF6 = 47 %, Ti = 0 %;
- –њ—А–Є —ЕNaBF4= 2 –Љ–Њ–ї—М –Є —ГNa2TiF6 = –Љ–Њ–ї—М: TiN = 62 %, BN = 15 %, Na3TiF6 = 21 %, Ti = 2 %;
- –њ—А–Є —ЕNaBF4 = 3 –Љ–Њ–ї—М –Є —ГNa2TiF6 = 1 –Љ–Њ–ї—М: TiN = 57%, BN = 50%, Na3TiF6 = 15%, Ti = 17 %;
- –њ—А–Є —ЕNaBF4 = 4 –Љ–Њ–ї—М –Є —ГNa2TiF6 = 1 –Љ–Њ–ї—М: TiN = 21 %, BN = 58%, Na3TiF6 = 2%, Ti = 19 %;
- –њ—А–Є —ЕNaBF4 = 1 –Љ–Њ–ї—М –Є —ГNa2TiF6 = 2 –Љ–Њ–ї—М: TiN = 71 %, BN = 3 %, Na3TiF6 = 3 %, Ti = 23 %;
- –њ—А–Є —ЕNaBF4 = 1 –Љ–Њ–ї—М –Є —ГNa2TiF6 = 3 –Љ–Њ–ї—М: TiN = 65 %, BN = 0 %, Na3TiF6 = 0 %, Ti = 35 %;
- –њ—А–Є —ЕNaBF4 = 1 –Љ–Њ–ї—М –Є —ГNa2TiF6 = 4 –Љ–Њ–ї—М: TiN = 53 %, BN = 0 %, Na3TiF6 = 0 %, Ti = 47 %.
–Ш–Ј —Н–Ї—Б–њ–µ—А–Є–Љ–µ–љ—В–∞–ї—М–љ—Л—Е —А–µ–Ј—Г–ї—М—В–∞—В–Њ–≤ —Д–∞–Ј–Њ–≤–Њ–≥–Њ –∞–љ–∞–ї–Є–Ј–∞ –≤–Є–і–љ–Њ, —З—В–Њ —Б —Г–≤–µ–ї–Є—З–µ–љ–Є–µ–Љ NaBF4 –≤ –Є—Б—Е–Њ–і–љ–Њ–є —Б–Љ–µ—Б–Є ¬ЂNaBF4+NaN3+Na2TiF6¬ї —Г–Љ–µ–љ—М—И–∞–µ—В—Б—П –Ї–Њ–ї–Є—З–µ—Б—В–≤–Њ TiN –Є –≥–∞–ї–Њ–Є–і–љ–Њ–є —Б–Њ–ї–Є Na3TiF6, –љ–Њ —Г–≤–µ–ї–Є—З–Є–≤–∞–µ—В—Б—П –Ї–Њ–ї–Є—З–µ—Б—В–≤–Њ BN –Є –њ–Њ—П–≤–ї—П–µ—В—Б—П Ti –≤ —Б–Њ—Б—В–∞–≤–µ –Ї–Њ–љ–µ—З–љ–Њ–≥–Њ –њ—А–Њ–і—Г–Ї—В–∞. –Р —Б —Г–≤–µ–ї–Є—З–µ–љ–Є–µ–Љ Na3TiF6 –≤ –Є—Б—Е–Њ–і–љ–Њ–є —Б–Љ–µ—Б–Є ¬ЂNaBF4+NaN3+Na2TiF6¬ї –љ–µ–Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ —Г–Љ–µ–љ—М—И–∞–µ—В—Б—П –Ї–Њ–ї–Є—З–µ—Б—В–≤–Њ TiN –Є BN, –Є –≤ –Ї–Њ–љ–µ—З–љ–Њ–Љ –њ—А–Њ–і—Г–Ї—В–µ –њ–Њ—П–≤–ї—П–µ—В—Б—П —В–Є—В–∞–љ. –Я–Њ–±–Њ—З–љ—Л–є –њ—А–Њ–і—Г–Ї—В Na3TiF6 –Њ—В—Б—Г—В—Б—В–≤—Г–µ—В.
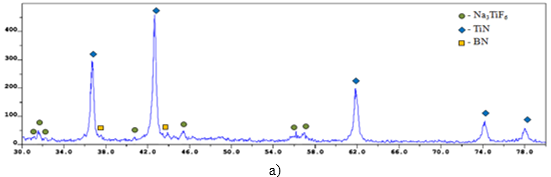
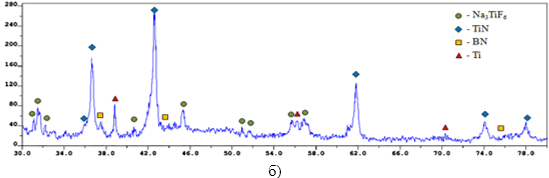
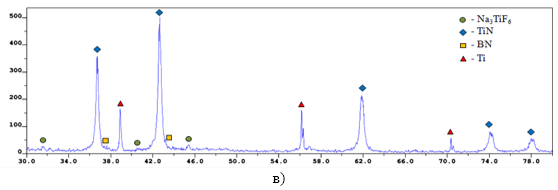
–†–Є—Б—Г–љ–Њ–Ї 2. –†–§–Р –Ї–Њ–љ–µ—З–љ—Л—Е –њ—А–Њ–Љ—Л—В—Л—Е –њ—А–Њ–і—Г–Ї—В–Њ–≤ —Б–Є–љ—В–µ–Ј–∞
—Б–Є—Б—В–µ–Љ—Л ¬Ђ—ЕNaBF4-NaN3-—ГNa2TiF6¬ї —Б —А–∞–Ј–љ—Л–Љ —Б–Њ–Њ—В–љ–Њ—И–µ–љ–Є–µ–Љ –≥–∞–ї–Њ–Є–і–љ—Л—Е —Б–Њ–ї–µ–є:
–∞) —ЕNaBF4 = 1 –Љ–Њ–ї—М –Є —ГNa2TiF6 = 1 –Љ–Њ–ї—М; –±) —ЕNaBF4 = 3 –Љ–Њ–ї—М –Є —ГNa2TiF6 = 1 –Љ–Њ–ї—М;
–≤) —ЕNaBF4 = 1 –Љ–Њ–ї—М –Є —ГNa2TiF6 = 3 –Љ–Њ–ї—М



–†–Є—Б—Г–љ–Њ–Ї 3. –Ь–Њ—А—Д–Њ–ї–Њ–≥–Є—П —З–∞—Б—В–Є—Ж –Ї–Њ–љ–µ—З–љ–Њ–≥–Њ –њ—А–Њ–і—Г–Ї—В–∞, —Б–Є–љ—В–µ–Ј–Є—А–Њ–≤–∞–љ–љ–Њ–≥–Њ –≤ —Б–Є—Б—В–µ–Љ–µ ¬Ђ—ЕNaBF4-NaN3-—ГNa2TiF6¬ї: –∞) —ЕNaBF4 = 1 –Љ–Њ–ї—М –Є —ГNa2TiF6 = 1 –Љ–Њ–ї—М;
–±) —ЕNaBF4 = 3 –Љ–Њ–ї—М –Є —ГNa2TiF6 = 1 –Љ–Њ–ї—М; –≤) —ЕNaBF4 = 1 –Љ–Њ–ї—М –Є —ГNa2TiF6 = 3 –Љ–Њ–ї—М
–Ш—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ —А–∞–Ј–Љ–µ—А–∞ –Є –Љ–Њ—А—Д–Њ–ї–Њ–≥–Є–Є –Ї–Њ–љ–µ—З–љ–Њ–≥–Њ –њ—А–Њ–і—Г–Ї—В–∞ –њ—А–Њ–≤–Њ–і–Є–ї–Њ—Б—М —Б –њ–Њ–Љ–Њ—Й—М—О —А–∞—Б—В—А–Њ–≤–Њ–≥–Њ —Н–ї–µ–Ї—В—А–Њ–љ–љ–Њ–≥–Њ –Љ–Є–Ї—А–Њ—Б–Ї–Њ–њ–∞ JSM-6390A —Д–Є—А–Љ—Л ¬ЂJeol¬ї (—А–Є—Б—Г–љ–Њ–Ї 3). –Ш–Ј —А–Є—Б—Г–љ–Ї–∞ 3 –≤–Є–і–љ–Њ, —З—В–Њ –Ї–Њ–љ–µ—З–љ—Л–є –њ—А–Њ–і—Г–Ї—В, —Б–Є–љ—В–µ–Ј–Є—А–Њ–≤–∞–љ–љ—Л–є –Є–Ј —Б–Є—Б—В–µ–Љ—Л ¬Ђ—ЕNaBF4-NaN3-—ГNa2TiF6¬ї –њ—А–Є –ї—О–±–Њ–Љ —Б–Њ–Њ—В–љ–Њ—И–µ–љ–Є–Є –Ї–Њ–Љ–њ–Њ–љ–µ–љ—В–Њ–≤ —Е –Є —Г –њ—А–µ–і—Б—В–∞–≤–ї—П–µ—В —Б–Њ–±–Њ–є —Б—Г–±–Љ–Є–Ї—А–Њ–Ї—А–Є—Б—В–∞–ї–ї–Є—З–µ—Б–Ї–Є–є –њ–Њ—А–Њ—И–Њ–Ї (TiN, BN, Na3TiF6, Ti) —А–∞–≤–љ–Њ–Њ—Б–љ–Њ–є —Д–Њ—А–Љ—Л —А–∞–Ј–Љ–µ—А–Њ–Љ 100-150 –љ–Љ [1].
.
–Ф–ї—П —Г—Б—В–∞–љ–Њ–≤–ї–µ–љ–Є—П –Љ–µ—Е–∞–љ–Є–Ј–Љ–∞ –Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є—П –љ–Є—В—А–Є–і–љ–Њ–є –Ї–Њ–Љ–њ–Њ–Ј–Є—Ж–Є–Є TiN-–ТN, –≤ –љ–∞–Є–ї—Г—З—И–µ–є –њ–Њ –≤—Л—Е–Њ–і—Г –Ї–Њ–љ–µ—З–љ–Њ–≥–Њ –њ—А–Њ–і—Г–Ї—В–∞ —Б–Є—Б—В–µ–Љ–µ ¬Ђ2NaBF4-10NaN3-Na2TiF6¬ї, –±—Л–ї–∞ –њ—А–Њ–Є–Ј–≤–µ–і–µ–љ–∞ –Ј–∞–Ї–∞–ї–Ї–∞ [2] –Є —Г—Б—В–∞–љ–Њ–≤–ї–µ–љ–Њ, —З—В–Њ —В–µ–Љ–њ–µ—А–∞—В—Г—А–∞ –≥–Њ—А–µ–љ–Є—П –і–∞–љ–љ–Њ–є —Б–Љ–µ—Б–Є —Б–Њ—Б—В–∞–≤–ї—П–µ—В 800 ¬∞–°, —Б–Ї–Њ—А–Њ—Б—В—М –≥–Њ—А–µ–љ–Є—П вАУ 1,00 —Б–Љ/—Б (—А–Є—Б—Г–љ–Њ–Ї 1). –Я—А–Є –Ј–∞–Ї–∞–ї–Ї–µ –Њ–±—А–∞–Ј—Ж–Њ–≤ –Є—Б—Б–ї–µ–і—Г–µ–Љ–Њ–є —Б–Љ–µ—Б–Є –≤ –Є–љ—В–µ—А–≤–∞–ї–µ —В–µ–Љ–њ–µ—А–∞—В—Г—А 500-600 ¬∞–° —А–µ–љ—В–≥–µ–љ–Њ—Д–∞–Ј–Њ–≤—Л–є –∞–љ–∞–ї–Є–Ј –њ–Њ–Ї–∞–Ј–∞–ї, —З—В–Њ –њ—А–Њ–і—Г–Ї—В—Л —Б–Є–љ—В–µ–Ј–∞ —Б–Њ—Б—В–Њ—П—В –Є–Ј —Б–Љ–µ—Б–Є —А–∞–Ј–ї–Є—З–љ—Л—Е (–≤ –Ј–∞–≤–Є—Б–Є–Љ–Њ—Б—В–Є –Њ—В —В–µ–Љ–њ–µ—А–∞—В—Г—А—Л –Ј–∞–Ї–∞–ї–Ї–Є) —Д–∞–Ј: –Т, Ti, –ТN, TiN, NaF, N2вЖС, BF3вЖС, Na3TiF6.
–Э–∞ –Њ—Б–љ–Њ–≤–∞–љ–Є–Є –њ–Њ–ї—Г—З–µ–љ–љ—Л—Е —Н–Ї—Б–њ–µ—А–Є–Љ–µ–љ—В–∞–ї—М–љ—Л—Е —А–µ–Ј—Г–ї—М—В–∞—В–Њ–≤ –±—Л–ї–∞ –њ–Њ—Б—В—А–Њ–µ–љ–∞ —Е–Є–Љ–Є—З–µ—Б–Ї–∞—П —Б—В–∞–і–Є–є–љ–Њ—Б—В—М –Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є—П –Ї–Њ–Љ–њ–Њ–Ј–Є—Ж–Є–Є TiN-–ТN –≤ —Б–Є—Б—В–µ–Љ–µ ¬Ђ2NaBF4-10NaN3-Na2TiF6¬ї.
1) –†–∞–Ј–ї–Њ–ґ–µ–љ–Є–µ –∞–Ј–Є–і–∞ –љ–∞—В—А–Є—П NaN3 –њ—А–Њ–Є—Б—Е–Њ–і–Є—В –њ—А–Є ~300¬∞C:
2NaN3 вЖС 2Na + 3N2вЖС. (1)
2) –Ґ–µ—В—А–∞—Д—В–Њ—А–±–Њ—А–∞—В –љ–∞—В—А–Є—П —А–∞–Ј–ї–∞–≥–∞–µ—В—Б—П –њ—А–Є –љ–∞–≥—А–µ–≤–∞–љ–Є–Є –≤—Л—И–µ —В–µ–Љ–њ–µ—А–∞—В—Г—А—Л –њ–ї–∞–≤–ї–µ–љ–Є—П (–≤—Л—И–µ 450¬∞C):
NaBF4 вЖС BF3 вЖС+ NaF. ` (2)
3) –°–ї–µ–і–Њ–Љ –Є–і–µ—В —А–µ–∞–Ї—Ж–Є—П –≤–Ј–∞–Є–Љ–Њ–і–µ–є—Б—В–≤–Є—П —Д—В–Њ—А–Є–і–∞ —Б –∞–Ї—В–Є–≤–љ—Л–Љ –љ–∞—В—А–Є–µ–Љ, –Њ–±—А–∞–Ј–Њ–≤–∞–≤—И–Є–Љ—Б—П –њ—А–Є —А–∞–Ј–ї–Њ–ґ–µ–љ–Є–Є –∞–Ј–Є–і–∞ –љ–∞—В—А–Є—П:
BF3 вЖС+ 3Na вЖС B + 3NaF. (3)
4) –І–∞—Б—В—М –Њ—Б—В–∞–≤—И–µ–≥–Њ—Б—П –љ–∞—В—А–Є—П –≤—Б—В—Г–њ–∞–µ—В –≤ —А–µ–∞–Ї—Ж–Є—О –≤–Њ—Б—Б—В–∞–љ–Њ–≤–ї–µ–љ–Є—П —Б –≥–µ–Ї—Б–∞—Д—В–Њ—А—В–Є—В–∞–љ–∞—В–Њ–Љ –љ–∞—В—А–Є—П, –њ—А–Є —В–µ–Љ–њ–µ—А–∞—В—Г—А–µ —А–∞–Ј–ї–Њ–ґ–µ–љ–Є—П Na2TiF6 (~600¬∞C):
5Na + Na2TiF6 вЖС Ti + 6NaF + Na. (4)
5) –Ф–∞–ї–µ–µ —Н–ї–µ–Љ–µ–љ—В–љ—Л–є —В–Є—В–∞–љ –Є –±–Њ—А, –≤—Б—В—Г–њ–∞—О—В –≤ —А–µ–∞–Ї—Ж–Є—О —Б –∞–Ї—В–Є–≤–љ—Л–Љ –∞–Ј–Њ—В–Њ–Љ, –Њ–±—А–∞–Ј—Г—П –љ–Є—В—А–Є–і —В–Є—В–∞–љ–∞ –Є –љ–Є—В—А–Є–і –±–Њ—А–∞ (~800¬∞C):
Ti + 0,5N2вЖС вЖС TiN. (5)
–Т + 0,5N2вЖС вЖС –ТN. (6)
–°—Г–Љ–Љ–∞—А–љ–∞—П —А–µ–∞–Ї—Ж–Є—П –њ–Њ–ї—Г—З–µ–љ–Є—П –Ї–Њ–Љ–њ–Њ–Ј–Є—Ж–Є–Є TiN-–ТN –Є–Љ–µ–µ—В –≤–Є–і:
2NaBF4 + 10NaN3 + Na2TiF6 = TiN-2BN + 14NaF + 13,5N2. (7)
–Э–µ–њ–Њ–ї–љ–Њ—В–∞ –њ—А–Њ—Е–Њ–ґ–і–µ–љ–Є—П —Е–Є–Љ–Є—З–µ—Б–Ї–Є—Е —А–µ–∞–Ї—Ж–Є–є, –≤–ї–Є—П—О—Й–∞—П –љ–∞ –њ–∞—А–∞–Љ–µ—В—А—Л –≥–Њ—А–µ–љ–Є—П –Є —Б–Є–љ—В–µ–Ј–∞, –њ—А–Є–≤–Њ–і–Є—В –Ї –њ–Њ—П–≤–ї–µ–љ–Є—О –≤ –њ—А–Њ–і—Г–Ї—В–∞—Е —Б–Є–љ—В–µ–Ј–∞ —З–Є—Б—В–Њ–≥–Њ –љ–µ–њ—А–Њ–∞–Ј–Њ—В–Є—А–Њ–≤–∞–љ–љ–Њ–≥–Њ —В–Є—В–∞–љ–∞, –Ї–Њ—В–Њ—А—Л–є –њ—А–Є –љ–Є–Ј–Ї–Є—Е —В–µ–Љ–њ–µ—А–∞—В—Г—А–∞—Е –љ–µ –≤–Ј–∞–Є–Љ–Њ–і–µ–є—Б—В–≤—Г–µ—В —Б –∞–Ј–Њ—В–Њ–Љ –Є –≥–∞–ї–Њ–Є–і–љ–Њ–є —Б–Њ–ї–Є Na3TiF6, –Ї–Њ—В–Њ—А–∞—П –Є–Ј-–Ј–∞ –љ–Є–Ј–Ї–Є—Е —В–µ–Љ–њ–µ—А–∞—В—Г—А –≥–Њ—А–µ–љ–Є—П –Њ–±—А–∞–Ј—Г–µ—В—Б—П –њ–Њ —А–µ–∞–Ї—Ж–Є–Є:
Na + Na2TiF6 вЖС Na3TiF6. (8)
–Ґ–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, –≤ –і–∞–љ–љ–Њ–є —А–∞–±–Њ—В–µ –±—Л–ї–∞ –њ–Њ–Ї–∞–Ј–∞–љ–∞ —Е–Є–Љ–Є—З–µ—Б–Ї–∞—П —Б—В–∞–і–Є–є–љ–Њ—Б—В—М –њ–Њ–ї—Г—З–µ–љ–Є—П –Ї–Њ–Љ–њ–Њ–Ј–Є—Ж–Є–Є TiN-–ТN –≤ –њ—А–Њ—Ж–µ—Б—Б–µ –≥–Њ—А–µ–љ–Є—П —Б–Љ–µ—Б–Є ¬Ђ2NaBF4 + 10NaN3 + Na2TiF6¬ї –Є —Г—Б—В–∞–љ–Њ–≤–ї–µ–љ–Њ, —З—В–Њ –Є–Ј-–Ј–∞ –љ–Є–Ј–Ї–Є—Е —В–µ–Љ–њ–µ—А–∞—В—Г—А –≥–Њ—А–µ–љ–Є—П (–Љ–µ–љ–µ–µ 600-800¬∞–°) –≤ –њ—А–Њ—Ж–µ—Б—Б–µ —Б–Є–љ—В–µ–Ј–∞ –°–Т–° –љ–µ –њ—А–Њ–Є—Б—Е–Њ–і—П—В –≤—Б–µ –љ–µ–Њ–±—Е–Њ–і–Є–Љ—Л–µ —Е–Є–Љ–Є—З–µ—Б–Ї–Є–µ —А–µ–∞–Ї—Ж–Є–Є –≤–Ј–∞–Є–Љ–Њ–і–µ–є—Б—В–≤–Є—П, –њ—А–Є–≤–Њ–і—П—Й–Є–µ –Ї –њ–Њ–ї—Г—З–µ–љ–Є—О —З–Є—Б—В–Њ–≥–Њ —Ж–µ–ї–µ–≤–Њ–≥–Њ –њ—А–Њ–і—Г–Ї—В–∞ - TiN-–ТN. –Т –Ї–Њ–љ–µ—З–љ–Њ–Љ –њ—А–Њ–і—Г–Ї—В–µ —Б–∞–Љ–Њ–≥–Њ –љ–∞–Є–ї—Г—З—И–µ–≥–Њ —Б–Њ—Б—В–∞–≤–∞ –љ–∞ —А—П–і—Г —Б –љ–Є—В—А–Є–і–∞–Љ–Є TiN (62%) –Є –ТN (15%) –њ—А–Є—Б—Г—В—Б—В–≤—Г–µ—В Na3TiF6 (21%) –Є Ti (2%) [3].
–°–њ–Є—Б–Њ–Ї –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–љ—Л—Е –Є—Б—В–Њ—З–љ–Є–Ї–Њ–≤
- –Ь–Њ–ї–Њ–і—Ж–Њ–≤–∞ –Ъ.–Т., –Ъ–Њ–љ–і—А–∞—В—М–µ–≤–∞ –Ы.–Р. –Ч–∞–≤–Є—Б–Є–Љ–Њ—Б—В—М –≤—Л—Е–Њ–і–љ—Л—Е –њ–∞—А–∞–Љ–µ—В—А–Њ–≤ –≥–Њ—А–µ–љ–Є—П –Є —Б–Є–љ—В–µ–Ј–∞ –Њ—В —Б–Њ–Њ—В–љ–Њ—И–µ–љ–Є—П –Ї–Њ–Љ–њ–Њ–љ–µ–љ—В–Њ–≤ –≤ —Б–Є—Б—В–µ–Љ–µ ¬Ђ–∞–Ј–Є–і –љ–∞—В—А–Є—П - –≥–∞–ї–Њ–≥–µ–љ–Є–і—Л NaBF4 –Є Na2TiF6¬ї // –Ь–µ–ґ–і—Г–љ–∞—А–Њ–і–љ–∞—П –љ–∞—Г—З–љ–Њ-–њ—А–∞–Ї—В–Є—З–µ—Б–Ї–∞—П –Ї–Њ–љ—Д–µ—А–µ–љ—Ж–Є—П ¬Ђ–Э–Њ–≤–∞—П –љ–∞—Г–Ї–∞: –Њ—В –Є–і–µ–Є –Ї —А–µ–Ј—Г–ї—М—В–∞—В—Г¬ї (29 –Є—О–љ—П 2016).- –≥. –°—Г—А–≥—Г—В, 2016.- –°.143-145.
- –Ъ–Њ–љ–і—А–∞—В—М–µ–≤–∞ –Ы.–Р., –Ъ–µ—А—Б–Њ–љ –Ш.–Р., –С–Є—З—Г—А–Њ–≤ –У.–Т. –•–Є–Љ–Є—З–µ—Б–Ї–∞—П —Б—В–∞–і–Є–є–љ–Њ—Б—В—М –Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є—П –љ–Є—В—А–Є–і–љ–Њ–є –Ї–Њ–Љ–њ–Њ–Ј–Є—Ж–Є–Є Si3N4-TiN –≤ —А–µ–ґ–Є–Љ–µ –°–Т–°-–Р–Ј // –Ь–µ–ґ–і—Г–љ–∞—А–Њ–і–љ—Л–є –љ–∞—Г—З–љ–Њ-–Є—Б—Б–ї–µ–і–Њ–≤–∞—В–µ–ї—М—Б–Ї–Є–є –ґ—Г—А–љ–∞–ї ¬Ђ–£—Б–њ–µ—Е–Є —Б–Њ–≤—А–µ–Љ–µ–љ–љ–Њ–є –љ–∞—Г–Ї–Є –Є –Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є—П¬ї, вДЦ8, –Ґ–Њ–Љ 3, 2016.- –°. 76-77.
- Amosov A.P., Shiganova L.A., Bichurov G.V., Kerson I.A. Combustion Synthesis of TiN-BN Nanostructured Composite Powder with the Use of Sodium Azide and Precursors of Titanium and Boron // Modern Applied Sciences, Vol.9, No.3, 2015, –°.133-144.









