Срочная публикация научной статьи
+7 995 770 98 40
+7 995 202 54 42
info@journalpro.ru
Применение активных упаковочных материалов с бактерицидными свойствами
Рубрика: Химические науки
Журнал: «Евразийский Научный Журнал №2 2022» (февраль, 2022)
Количество просмотров статьи: 1099
Показать PDF версию Применение активных упаковочных материалов с бактерицидными свойствами
Кузьмич В.В.,
Карпунин В.И.,
Карпунин И.И.,
Козлов Н.Г.
Белорусский национальный технический университет
Институт физико-органической химии НАН Беларуси
УДК 620.75
Введение
Применение материалов с антибактериальными свойствами позволит остановить рост микроорганизмов и обеспечить непрерывную антибактериальную защиту промышленным и продовольственным товарам, находящимся в упаковке. Целью проведенных исследований является разработка состава материала на основе полимера и биоцидов растительного происхождения для упаковки медицинских изделий. Биоцидные продукты в составе упаковочных материалов предназначены разрушать, удалять или делать неэффективными такие вредные организмы как бактерии, вирусы и грибки. Они должны быть не только эффективны против вредных организмов, но должны полностью разлагаться естественным путем и снижать прямые (связанные с токсичностью) или непрямые (связанные с хронической токсичностью) риски для человека. Активные компоненты биоцидных продуктов обычно являются активными веществами химической природы, иногда активными веществами натурального происхождения или же смесью того и другого. Биоцидные продукты должны быть не токсичными и/или не вредными для человека и окружающей среды, а также биоразлагаемыми и биосовместимыми для человека[1,2]. Этими качествами обладают биоциды растительного происхождения. В то же время они должны быть веществами антисептическими — задерживающими развитие микроорганизмов, и дезинфицирующими — убивающими микробы.
Эту задачу можно решить путем создания композиционных материалов, которые являются результатом объемного сочетания разнородных компонентов, один из которых образует матрицу (связующее), а другой (наполнитель) с определенными функциональными свойствами.
В качестве материала матрицы и наполнителя могут выступать самые разнообразные по природе и происхождению материалы.
В настоящее время в мире проводятся интенсивные исследования по созданию полимерных композитов с улучшенными барьерными свойствами. Одним из вариантов в качестве основы композита могут быть использованы полиолефины. Полимерный композит может быть получен тремя основными методами: в растворе, в расплаве и в процессе синтеза полимера.
Разработана и широко используется технология MicrobanR — это встроенная антибактериальная защита для твёрдых изделий, поверхностей и волокон, обеспечивающая продукты дополнительным уровнем защиты и предотвращающая рост вредоносных микробов, например, бактерий, грибов плесени, которые вызывают образование пятен, неприятного запаха и порчу изделий. Используемая компанией COLOP технология серебра третьего поколения, представляет собой матрицу. С её помощью технология Microban 3G Silver™ оптимизирует активную и долгосрочную защиту от бактерий и других микроорганизмов[3,4].
Активным веществом биоцидных композиций является по меньшей мере одна органическая кислота растительного происхождения. Из органических кислот, подходящих для введения в состав биоцидных композиций можно назвать, в частности, уксусную , муравьиную , лимонную кислоту, сорбиновую, молочную, янтарную, винную , яблочную кислоту и пировиноградную кислоты. Выбор органической кислоты проводится в зависимости от области применения биоцидных композиций и от организмов, которые хотят устранить или размножение которых желают замедлить или заблокировать. Наиболее предпочтительными являются молочная и лимонная кислота. Молочной кислоте, форма (L+), присуще свойство противодействия микроорганизмам, так как она действует непосредственно на внутриклеточный pH, а также на их энергетический цикл и обладает противомикробным действием, ингибируя их размножение (в том числе размножение Escherichia coli)[5, 6].
Наиболее дешевыми бактерицидными упаковочным материалом может служить многослойная полиэтиленовая пленка полученная методом экструзии с сорбционным материалом на основе кремнийорганического сорбента, модифицированного медью. Эта многослойная полиэтиленовая пленка используется для паллетирования грузов на поддонах. Она состоит из основного слоя и содержит в качестве основного компонента линейный полиэтилен и, по меньшей мере, одного слоя адгезивного материала, несовместимого с линейным полиэтиленом. Многослойная полиэтиленовая пленка выполнена в форме рукава[7].
Более дорогим бактерицидным упаковочным материалом может служить полиэтилен, в отверстия которого внедрены бактерицидные компоненты (например, наночастицы серебра или меди). Способ получения бактерицидного материала включает формирование необходимой формы из полимерной основы, формирование отверстий в полимерной основе за счет облучения высокоэнергетическими частицами, заполнения отверстий, бактерицидными компонентами[8]. Таким образом, бактерицидные компоненты бактерицидного материала, в котором упакованы любые продукты питания или медицинские средства, будут препятствовать процессу развития микроорганизмов и бактерий. Бактерицидный материал может быть изготовлен следующим образом. В качестве полимерной основы используют полиэтиленовая пленка, толщиной 30 мкм. Она располагается в вакуумной камере и облучается пучком ионов ксенона с энергией 1,2 МЭВ/нуклон в течение 10 минут. Благодаря этому в пленке создаются несквозные отверстия (для прохождения пленки насквозь энергия нуклонов должна быть большей), диаметром до 30 нм. Полиэтиленовая пленка располагается в ванне с водной суспензией наночастиц серебра (диаметр наночастицы серебра также должен быть менее 30 нм) на 15 минут. Положительный и отрицательный электроды ванны изготовлены в виде пластин, которые располагаются параллельно пленке, со стороны с отверстиями и без. Наночастицы серебра двигаются от положительного электрода к отрицательному и попадают в отверстия полиэтиленовой пленке, где и осаждаются.
Известна бактерицидная композиция, содержащая в качестве активных компонентов йодсодержащие органические соединения, а также вспомогательные вещества, в которую входят:
— оксиэтиленированный жирный спирт, содержащий 8 молей оксида этилена;
— повторно сублимированный металлический йод;
— пропантриол или глицерин для устранения вяжущего действия свободного йода, который, возможно, содержится в композиции;
— моноглицерид полиоксиэтиленированной жирной кислоты с целью снизить величину поверхностного натяжения среды, в которой он действует, в результате чего достигаются быстрое увлажнение клеточной стенки в случае бактерий или разрушение различных белков, которые могут образовывать вирусную капсулу;
— этиленгликоль с целью предотвратить вступление свободного йода в реакцию с другими компонентами бактерицидной композиции.
В практической деятельности человека широко используются природные материалы, основой которых является целлюлоза и пластические материалы, в то же время они служат источником углеродного питания для многих живых организмов, в первую очередь для мицелиальных грибов.
Среди мер борьбы с биоповреждениями материалов первое место занимают химические средства защиты — антисептические составы (АС). Они должны отвечать ряду требований: быть токсичными по отношению к грибам и насекомым, но безвредными для человека и животных; хорошо проникать в материал, быть стойкими во времени, не снижать прочность, не портить внешнего вида; не вымываться водой и т. д. Важными требованиями также являются: биозащищаемость, высокие антикоррозионные и адгезивные свойства. Несмотря на достаточно большой выбор АС, проблема защиты материалов, изделий и сооружений от биологического повреждения по-прежнему является актуальной, так как только учтенные потери от биоповреждений составляют 5–7% стоимости мировой промышленной продукции и имеют тенденцию к росту.
В настоящее время на рынке стран СНГ преобладают традиционные хлорсодержащие антисептические средства (хлорамин, гипохлорит и др.), нафтенат меди, препараты, содержащие α-пирен, а также фенольные препараты, которым присущ ряд существенных недостатков: высокая токсичность, относительно невысокая активность в отношении большинства патогенных микроорганизмов и грибков. Кроме того, их рабочие растворы малостабильны, коррозионно-активны, имеют выраженный запах, раздражают кожу и слизистые оболочки, повреждают защищаемые материалы.
Предварительный анализ литературных данных и ассортимента продукции, вырабатываемой лесохимическими компаниями Финляндии, США, Германии, Канады, Китая и России показывает, что смолы, полученные на основе продуктов переработки сосновой живицы, могут находить применение для синтеза антисептических средств. Получаемые антисептические средства обладают широким спектром биоцидных свойств и могут быть использованы в защитных составах (ЗС) и покрытиях различного назначения, применяемых в электротехнической, лакокрасочной, деревоперерабатывающей, бумажной промышленности и машиностроении.С целью импортозамещения, снижения себестоимости и повышения конкурентоспособности АС актуальной задачей является разработка широкого спектра высокоэффективных терпеноидных продуктов, полученных на основе отечественного возобновляемого лесохимического сырья и обладающих антисептическими, адгезионными и антикоррозионными свойствами.
Произведен скрининг семнадцати соединений терпеноидной природы, который позволил выявить наличие фунгицидной активности у a-терпениола и сульфатного скипидара. Показано, что a-терпениол оказывал фунгицидное действие на четырнадцать видов микромицетов, являющихся активными биодеструкторами различных промышленных материалов. В статье представлены новые подходы к биологически активным соединениям с использованием канифольно-экстракционных полимеров, также различных терпеноидных соединений, которые применяются для санации, дезодорации помещений, для обработки семян различных растений. Исследована их фунгицидная активность. Терпеноиды — кислородосодержащие органические соединения, как правило, природного происхождения. Поэтому, с целью расширения возможности применения этого эффективного и уникального природного продукта целесообразно и практически важно проведение широкого комплекса исследований по созданию на его основе методами химического модифицирования новых антисептических составов, обладающих широким диапазоном антисептических и физико-химических свойств.
Предмет исследований. Предметом настоящих исследований является упаковочный материал для медицинских изделий. Ввиду того, что медицинские изделия подвержены плесневым поражениям, для эффективной их защиты используется целая система мероприятий по применению химических средств. Они должны сочетать высокую эффективность в борьбе с агентами биоповреждений, с низкой токсичностью по отношению к животным и человеку, быть экономичными, совместимыми с другими компонентами ( полимерные материалы и т.д.).В настоящее время для антисептирования медицинских инструментов используют: водорастворимые, органорастворимые и масляные антисептики, а также антисептические пасты.
Согласно литературным данным, N-(диметиламинометил) имидмалеопи- маровой кислоты обладает фунгицидной и бактерицидной активностями против синегнойной палочки, грибов мучнистой росы, сырой гнили и мог бы найти применение в садоводстве, цветоводстве и промышленности, если бы производство исходной малеопимаровой кислоты было налажено лесохими- ческой промышленностью.
Известен фунгицидный состав для пропитки древесины, содержащий растворимую часть (85–95% канифоли, химически модифицированной при температуре 175—180°C, и 5–15% CuO), а также органический растворитель — скипидар. Состав предохраняет лесоматериалы от загнивания и поражения насекомыми.
Состав для обработки древесины с водоотталкивающими и фунгицидными свойствами содержит пентаэритритовый эфир смеси смоляных и жирных кислот в количестве 1–30%, полихлорфенола — 0,1–20%, парафина — 4–8%, остальное — растворитель и вода. Однако недостатками таких композиций является использование в качестве фунгицидной добавки резинатов меди и полихлорфенола, которые являются высокотоксичными веществами и частично растворяются в воде, что дает возможность их вымывания из композиций, нанесенных на древесину или пряжу, тем самым увеличивая вероятность их биоповреждений.
Известен способ получения антисептической добавки, заключающийся в обработке терпеномалеиновой смолы этаноламином при массовом соотношении соответственно 10 : (0,8–1,0) и температуре 150—170°C в течение 2–3 часов. Образующийся при этом N-(оксиэтил)имидтерпеномалеинового аддукта (ТМА) обладает антисептическими свойствами (эффективен против аэробных и анаэробных бактерий) и используется в качестве добавки при пропитке пеньковой пряжи, применяемой при изготовлении силовых кабелей. Поэтому актуальны исследования посвященные получению и изучению свойств антисептических средств не содержащих связанной меди.
Предложен упаковочный антисептический материал для металлопродукции, выполненный из двух слоёв крепированной бумаги, пропитанной парафином или дистиллятнымгачем, и склеенным битумом. Материал содержит крепированную бумагу, пропитанную смесью парафина или дистиллятногогача с талловым пеком, при следующем соотношении компонентов, мас. %: крепированная бумага 20–45, битум 20–50, парафин или дистиллятныйгач 20–40, талловый пек 1–5.
Как видно из вышесказанного, разработан широкий ассортимент антисептиков на основе возобновляемого лесохимического сырья. В зависимости от применяемого сырья и условий получения можно синтезировать антисептики с широким диапазоном биоцидных, физико-механических и других свойств.
Наиболее распространенными являются антисептики, полученные на основе канифоли, скипидара и таллового масла. Канифоль находит широкое применение в промышленности в композиционных составах различного назначения благодаря уникальной возможности совмещаться с некоторыми полимерными материалами.
Для получения антисептических составов, включающих в свою структуру фунгицид, пленкообразователь и растворитель, были выбраны следующие составляющие. В качестве фунгицида использовался продукт взаимодействия сосновой живичной канифоли (СЖК) (ОАО «Лесохимик» с параметрами: температура размягчения (Тразм) Тразм = 73ºС, и кислотное число (КЧ ) КЧ = 172 мгKOH/г),диспропорционированная канифоль (ДЖК) (Тразм = 62ºС, КЧ = 162 мгKOH/г) и талловый пек. Кислотное число — количество миллиграммов гидроокиси калия (КОН), требуемое для нейтрализации свободных жирных кислот, содержащихся в 1 г жира или масла. Диэтилентриамин (ДЭТА) использовался в качестве химического модификатора канифолей в количестве 0,5 мас.%. Температура реакции составляла Т=195±5ºС, время реакции 6 часов. В качестве пленкообразователя выбрана алкилфенолформальдегидная смола. В качестве растворителя использовался скипидар.
Взаимодействие живичной и диспропорционированной канифоли с диаминами проводили в реакторе, снабженном механической мешалкой, термометром и холодильником. Канифоль загружали в реактор и включали электрообогрев. При достижении температуры 100°C включали мешалку и перемешивали до получения однородной массы. При температуре 100—105°C загружали диамин. В течение 30–40 минут температуру смеси повышали до 190±5°C и поддерживали ее на этом уровне до конца процесса. В процессе реакции контролировали температуру и интенсивность перемешивания. Контроль над ходом реакции осуществляли путем отбора проб и определения их кислотного числа (КЧ). При достижении реакционной смесью постоянного КЧ мешалку отключали и отгоняли реакционную воду и непрореагировавший диамин под вакуумом при остаточном давлении 10–15 мм.рт.ст. и температуре 190±5°C. После завершения отгонки конечный продукт выливали в отдельные формы, где он окончательно остывал. Определение температуры размягчения (Тр) и кислотного числа (КЧ) проводили по методике [9].
Талловый пек применялся следующего состава, масс.%: смоляные кислоты — 20,4, жирные кислоты — 28,1, неомыляемые вещества — 22,8, окисленные вещества — 28,7. Талловый пек обрабатывался полиэтиленполиамином (ПЭПА) при температуре 190ºС в течении 2 часов. Полученная антисептическая добавка представляет собой темнокоричневую твердую массу с температурой размягчения 35ºС.
Физико-химические свойства фунгицидных добавок представлены в таблице 1
Таблица 1. Влияние канифоли и талового пека на физико-химические характеристики фунгицидных добавок
| № п/п | Состав реакционной смеси, масс,% | Физико-химические характеристики | |||
| канифоль | ДЭТА | ПЭПА | Тразмягчения ºС | КЧ мгKOH/г | |
| 1 | СЖК | 30 | - | 50,0 | 48,0 |
| 2 | ДКЖ | 30 | - | 40,0 | 40,29 |
| 3 | Таловый пек | - | 20 | 38,0 | 30,0 |
Из данных табл.1 видно, что, обработка канифоли и талового пека аминами приводит к значительному снижению кислотного числа и температуры размягчения (Тразм) получаемых продуктов. Это показывает полноту протекания реакции и отсутствие карбоксильных групп.
Канифоль состоит из лабильных смоляных кислот (СК), которые легко превращаются друг в друга в различные соединения, что сказывается на качестве продукции, поэтому требуются надежные и экспрессные методы их контроля. В настоящее время для анализа СК используются различные методы хроматографии. Однако эти методы имеют ряд недостатков: 1) СК необходимо переводить в метиловые эфиры; 2) не все компоненты смеси разделяются; 3) возможно разложение СК в колонке из-за высокой температуры.
Спектроскопический метод исследования химических объектов, использующий явление ядерного магнитного резонанса (ЯРМ-спектроскопия). Метод ЯМР выявляет информацию о молекулярном строении химических веществ, позволяет изучить динамические процессы в образце — определять константы скорости химических реакций, величину энергетических барьеров внутримолекулярного вращения. Все исследуемые образцы канифолей растворяли в CDCl3 (10%).CDCl3-дейтериохлороформ для растворения соединений для ЯРМ-спектроскопии. Спектры записывали на ЯМР спектрометре AVANCE—500 (500 МГц для ядер 1Н и 125 МГц — для 13С), рис. 1.

Рис.1 ЯМР — спектрометр AVANCE-500
Химические сдвиги сигналов протонов соединений определяли по сигналу хлороформа (d = 7,27 м.д., примесь), а химические сдвиги 13С измеряли относительно сигнала растворителя (d = 77,7 м.д.). Для идентификации и количественного определения содержания СК были записаны спектры индивидуальных кислот: абиетиновой (1), дегидроабиетиновой (2), изопимаровой (3), левопимаровой (4), неоабиетиновой (5), палюстровой (6) и пимаровой (7). Кроме того, были записаны спектры растворов в CDCl3 композиций названных канифолей, обработанных 30 % диэтилентриамином.
На рис. 1а показан спектр 1Н ЯМР сосновой живичной канифоли, состоящий из областей поглощения ароматических, олефиновых и алифатических протонов. Видно, что наиболее удобны для анализа первые две области (рис. 1б). Цифрами обозначены линии, принадлежащие соответствующим СК.
Были записаны спектры растворов в CDCl3 композиций названных канифолей, обработанных 30 % диэтилентриамином. На рис. 2а показан спектр 1Н ЯМР сосновой живичной канифоли, состоящий из областей поглощения ароматических, олефиновых и алифатических протонов. Видно, что наиболее удобны для анализа первые две области (рис. 7.2б). Цифрами обозначены линии, принадлежащие соответствующим СК.
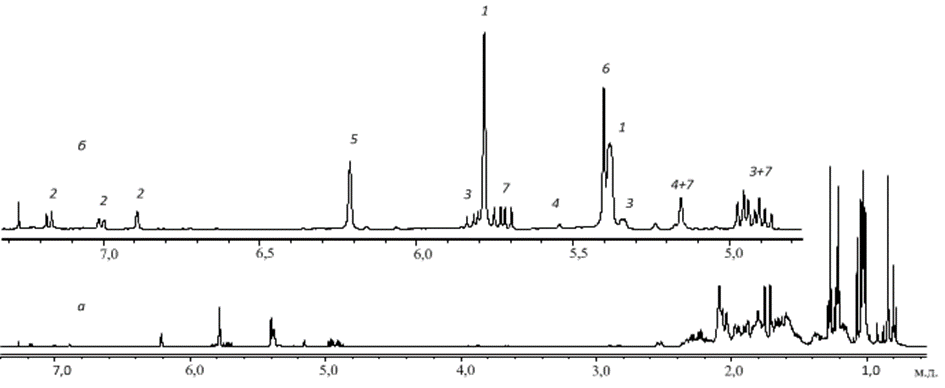
Рис. 7.21Н ЯМР спектр раствора сосновой живичной канифоли в CDCl3: а — полный спектр, б — область ароматических и олефиновых протонов
Рисунок 3а отображает 13С ЯМР спектр этого же образца. Поскольку все линии практически индивидуальны, для анализа можно использовать весь спектр, но наиболее удобна область поглощения ароматических и олефиновых углеродов (рис. 3б). Здесь, как и на рис. 7.2б, цифрами обозначены линии поглощения соответствующих СК.
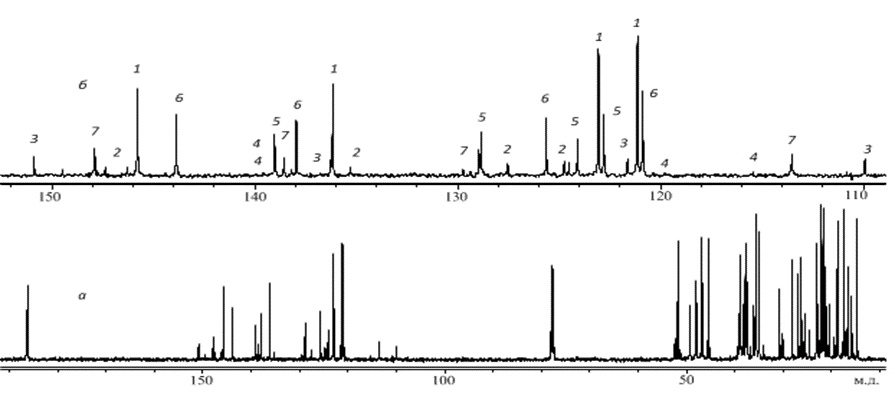
Рис. 3. 13С ЯМР спектр раствора сосновой живичной канифоли в CDCl3: а — полный спектр, б — область ароматических и олефиновых углеродов
На рисунке 4а показан 1Н ЯМР спектр диспропорционированной канифоли (область ароматических и олефиновых протонов). Цифрами обозначены линии, принадлежащие протонам соответствующих кислот.
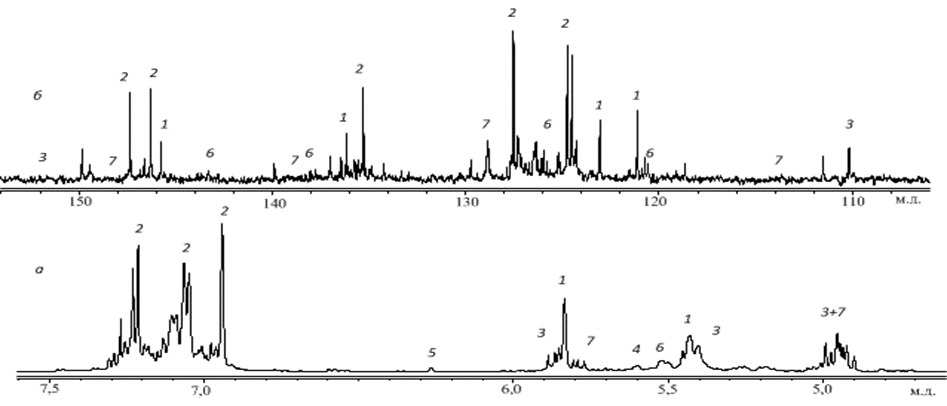
Рис. 4 ЯМР спектр раствора диспропорционированной канифоли в CDCl3 (область ароматических и олефиновых сигналов): а — 1Н, б — 13С
Результаты количественного анализа состава исследованных образцов канифолей представлены в табл.2.
Таблица 2 Состав канифолей
| № п/п | Состав реакционной смеси, масс,% | Физико-химические характеристики | |||
| канифоль | ДЭТА | ПЭПА | Тразмягчения ºС | КЧ мгKOH/г | |
| 1 | СЖК | 30 | - | 50,0 | 48,0 |
| 2 | ДКЖ | 30 | - | 40,0 | 40,29 |
| 3 | Таловый пек | - | 20 | 38,0 | 30,0 |
Фунгитоксичность биоцидных добавок на основе канифоли к плесневым грибам. Для определения фунгицидной активности полученных продуктов была проведена экспресс-оценка способности вакуумного дистиллята ВД-2 с растворенными в нем фунгицидными добавками противостоять поражению образцов плесневыми грибами . Испытуемые образцы размером 30×20×2 мм изготавливали из полиэтилена, на 1 мин помещали в расплавы ВД-2 с 20 % антисептических добавок.
Фунгитоксичность образцов по отношению к плесневым грибам оценивали методом «агаровой сетки» питательной среды Чапека-Докса, инокулированной спорами гриба Aspergillusniger (А.niger), отличающегося повышенной устойчивостью к действию антисептиков. Эта питательная среда является полусинтетической средой с нитратом натрия в качестве источника азота, ее используют для культивирования грибов. Чашки инкубировали при температуре 28°C в течение 8 сут., ячейки агаровой сетки ежедневно переносили на предметные стекла и микроскопировали в проходящем свете. Критерием фунгитоксичности служила лаг-фаза, т.е. время от постановки опыта до начала прорастания спор. Если лаг-фаза у образцов составляла более 8 суток, то считалось, что образцы на фунгитоксичность выдержали испытания .
В табл. 3 приведены данные Прорастание спор гриба Aspergillusniger на агаровой сетке среды Чапека-Докса, нанесенной на образцы, обработанные дистиллятом ВД-2 с 20,0 мас.% фунгицидных добавок канифоли (СЖК и ДЖК), полученные химическим модифицированием ДЭТА.
Таблица 3.Прорастание спор гриба Aspergillusniger на агаровой сетке среды Чапека-Докса,
| Образец | Прорастание спор гриба* | Лаг-фаза, сут | |||
| 1 сут | 2 сут | 3 сут | 8 сут | ||
| СЖК | — | — | — | — | > 8 |
| ДЖК | — | — | — | — | > 8 |
Примечание: * нет роста
Грибостойкость пропитанных образцов пряжи оценивали в соответствии с ГОСТ 9.048 [10], метод 4 по степени развития плесневых грибов в условиях, имитирующих минеральное и органическое загрязнение. Образцы были опрысканы суспензией спор грибов Alternariaalternata, Aspergilluscarbonarius, Aspergillusniger, в среде Чапека-Докса и помещены в эксикаторы, на дне которых налита вода. Эксикаторы находились в сухо-воздушном термостате при температуре 28°C.Через 15 и 30 суток инкубации образцы осматривали под микроскопом в отраженном свете при увеличении в 60 раз при освещенности 200 люкс. Грибостойкость оценивали по интенсивности развития грибов в соответствии с ГОСТ 9.048 [10,11] по баллам: 0 — под микроскопом прорастания спор и конидий не обнаруживается; 1 — под микроскопом видны проросшие споры и незначительно развитый мицелий; 2 — под микроскопом виден развитый мицелий, возможно спороношение; 3 — невооруженным глазом мицелий и спороношение едва видны, но отчетливо видны под микроскопом; 4 — невооруженным глазом отчетливо видно развитие грибов, покрывающих менее 25% испытуемой поверхности; 5 — невооруженным глазом отчетливо видно развитие грибов, покрывающих более 25% испытуемой поверхности.
Далее на основе канифолей (СЖК и ДЖК), химически модифицированных ДЭТА, были приготовлены пропиточные составы для защиты древесины, рецептуры которых приведены в табл. 4.
Таблица 4. Рецептуры пропиточных составов и результаты испытаний пропитанных образцов древесины на устойчивость к воздействию плесневых, грибов
| № рецептуры | Фунгицидная добавка, мас.% | Пленкообразующий компонент -алкилфенолформальдегидная смола), мас.% | Растворитель, мас.% | Грибостойкость*** | Потеря массы****, мас.% | |
| Площадь пораже нияя, % | Стадия развития грибов, баллы | |||||
|
9–20* |
20 | 30 | 50 | 10 | 1 | 3,1 |
|
9–25* |
25 | 25 | 50 | 0 | 0 | 2,8 |
|
9–30* |
30 | 20 | 50 | 0 | 0 | 2,0 |
|
10–20** |
20 | 30 | 50 | 15 | 2 | 3,6 |
|
10–25** |
25 | 25 | 50 | 0 | 0 | 2,5 |
|
10–30** |
30 | 20 | 50 | 0 | 0 | 1,8 |
| Контроль | 100 | 5 | 48,1 | |||
* — в рецептуре использована в качестве фунгицидной добавки СЖК, модифицированная ДЭТА;
** — в рецептуре использована в качестве фунгицидной добавки ДЖК, модифицированная ДЭТА.
Содержание фунгицидных добавок варьировали от 20 до 30 мас.%. В качестве пленкообразующих компонентов использовалась алкилфенолформальдегидная смола, а в качестве растворителя — скипидар.
Биозащитные свойства составов по отношению к плесневым и деревоокрашивающим грибам испытывали в соответствии с ГОСТ 30028.4-2006 «Средства защитные для древесины, экспресс-метод оценки эффективности против деревоокрашивающих и плесневых грибов» [12]. Образцы древесины сосны размером 10×55×75 мм с покрытием испытывали грибеAspergillusniger. Образцы выдерживали во влажной камере при относительной влажности 87–90% и температуре 26°C. Контролем служили образцы непропитанной древесины. Площадь поражения поверхности образцов при осмотре под микроскопом в отраженном свете при увеличении в 200 раз оценивали визуально через 5, 10 и 15 суток инкубации.
По окончании испытаний определяли стадию развития грибов по 5-бальной шкале и с учетом характеристик, обозначенных в ГОСТ 30028.4-2006 (0 — абсолютно чистые образцы при визуальном осмотре и под микроскопом; 1 — визуально чистые образцы, при осмотре под микроскопом видны мелкие очаги в виде одного вида гриба, стадия спороношения отсутствует; 2 — поверхностное развитие мицелия отдельных видов грибов, стадия спороношения отсутствует;3 — обильное разрастание мицелия отдельных видов грибов, начало стадии спороношения одного из видов; 4 — отчетливо виден рост грибов при визуальном осмотре, различные стадии спороношения большинства видов; 5 — глубокое поражение по всей площади образца, интенсивное спороношение).
Как видно из данных табл. 4, составы 9–25, 9–30, 10–25, 10–30 полностью подавляют рост плесневых грибов, а оптимальное соотношение в пропиточных составах модифицированной канифоли составляет 25–30 мас.%.
Таким образом, бактерицидные компоненты бактерицидного материала, в котором упакованы любые продукты питания или медицинские средства, препятствуют процессу развития микроорганизмов и бактерий. Причём активным веществом биоцидных композиций является органическая кислота растительного происхождения.
Литература
1. Богаров Б.В., Прокофьев А.К. // Биоповреждения и защита материалов биоцидами. М.: Наука, 1988. С. 20–27.
2. Зандерман В. Природные смолы, скипидары, талловое масло. М.: Лесная промышленность, 1964. 576 с.
3. TangYing, TanShi-yu .Xianminzuxueyuanxuebao. — 2003. — № 3. — С. 363-366.
4. Насакин, О. Е. Использование в сельском хозяйстве экстрактивных компонентов древесины / О Е. Насакин, Т. Н. Оверчук // Материалы I по лесохимии и органическому синтезу. — Сыктывкар, 3-6 окт., 1994
5. А.с. 481597 СССР, МПК C 07 C 103/30. Способ получения N-(оксиэтил)имидамалеопимаровой кислоты // Б.И. 1975. № 31.
6. Новиков, В. И Упаковочный материал для металлопродукции / В. И. Новиков // Всес. научн.-исслед. проект.-конструкт. и технол. ин-т кабел. пром-сти. — № 4099585/24-12, (114061). 2012.
7. Скаковский Е.Д., Тычинская Л.Ю., Гайдукевич О.А., Козлов Н.Г., Клюев А.Ю., Ламоткин С.А., Шпак С.И., Рыков С.В. // Журнал прикладной спектроскопии. 2008. Т. 75. № 3. С. 411–415.
8. Разработка рецептуры и технологии получения смазки для пропитки органических сердечников стальных канатов с применением нафтената меди и его аналогов : отчет о НИР (заключ.) / Институт химии новых материалов НАН Беларуси. Минск, 2006. 54 с. № ГР 20052232.
9. Способ получения многослойной полиэтиленовой пленки для паллетирования грузов на поддонах. Патент Украины 86517, бюл.8, 2009 г.(10)
10. Разработка рецептуры и технологии получения антисептического состава для защиты древесины на основе лесохимического и растительного сырья : отчет о НИР (заключ.) / Институт химии новых материалов НАН Беларуси. Минск, 2007. 56 с. № ГР 2006899.









