Срочная публикация научной статьи
+7 995 770 98 40
+7 995 202 54 42
info@journalpro.ru
Demonstration of anticorrosive effect of Delhi iron pillar.
Рубрика: Технические науки
Журнал: «Евразийский Научный Журнал №4 2018» (апрель, 2018)
Количество просмотров статьи: 2503
Показать PDF версию Demonstration of anticorrosive effect of Delhi iron pillar.
Ревашин Борис Геннадьевич
Перевод статьи „Антикоррозийный эффект железного столба Кутуб-Минар демонстрирует учебно — наглядное пособие”, опубликованной в № 12 за 2015 год в „Евразийском Научном Журнале” [3].
Boris Revashin / Борис Ревашин; Olga Klimenko/ Ольга Клименко;Tatiana Zolotova/ Татьяна Золотова.
Key words: Anticorrosive effect; Delhi (Qutub Minar) iron pillar; Educationally-visual set.
Educationally — visual set for demonstration of an anticorrosive effect of the Delhi iron pillar was made for students who study chemistry, physics and related disciplines in schools, colleges, universities, institutes.
The kit contains: methodical materials; description of the essence of scientific discovery [L 1]; lecture materials and illustrations; technical means of demonstration of effect; iron plates length 30 mm, width 10 mm, thickness 1 mm. Start of the experiment — free choice of plates, application of water droplets on them.
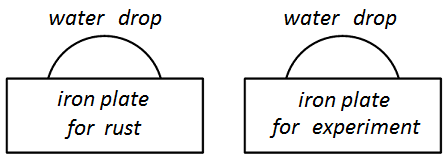
The figure1: two iron plates and two water drops before start of experiment.
Water drops are drying on the iron plates for 45 — 55 minutes. The drying time depends on the temperature and of humidity of the air.
1. The plate for rust — will be the rusting plate in during experiment.
There are two phases of drying the water drop on the rust plate. The first phase lasts from the start 5 — 12 minutes.
This is process of the formation of iron hydroxide Fe (OH) 2 — an unstable chemical substance of gray or light gray color and poorly dissoluble in water. Iron hydroxide does not disturb the surface of the plate.
![]()
Electrons exit from the surface of the plate into a drop of water, so decreases the number of electrons in the iron plate and then the second phase of rust formation begins. The second phase of the drying of the water drop — it is formation of rust:
![]()
The rust is insoluble chemical substance in a water. The rust has brown color or red — brown color.
Anode sections are formed on the surface of the rust plate under a drop of water:
![]()
And cathode sections:
![]()
The figure 2 is a copy of picture 18.8 from the page 624, [2].
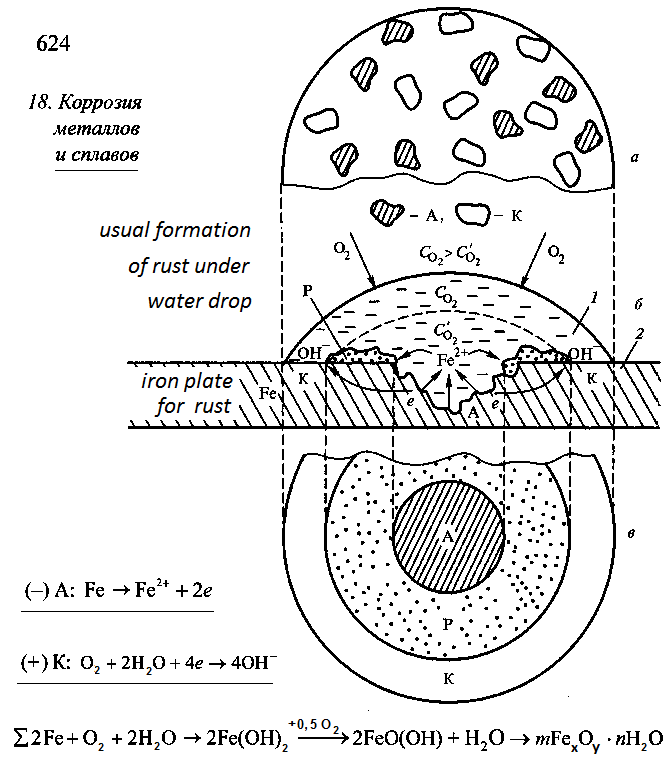
The figure 2 shows scheme of the process of formation of corrosion on the rust plate under water droplet.
On the rust plate the equipotential of the iron surface is violated. Electron — ion balance in the crystal lattice of iron is violated too: number electrons are less than number of ions. Corrosion remains on the rust plate after the drying of the water droplet at the end of the experiment.
2. The experimental plate is connected to the emitter of electrons.
From the emitter electrons go to the iron plate — it is free electrons. Coulomb’s forces distribute free electrons on the surface of the plate. The free electrons block formation of anode sections on the surface of the experimental plate under of water droplet, and this free electrons make equipotential surface. Also free electrons keep electron — ion balance in the crystal lattice of iron in the experimental plate. [L 2, р. 651].
Electrons exit from the surface of the experimental plate into a water drop for formation of iron hydroxide during the drying time. Free electrons prolong the first phase of iron hydroxide and block second phase of rust formation. The experimental plate becomes free from rust:
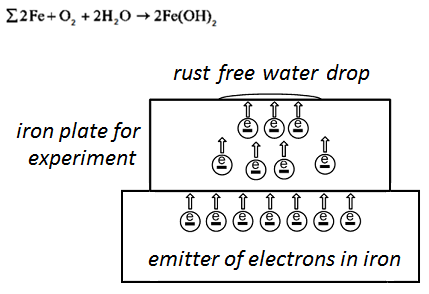
The figure 3 shows the drying of a water drop without corrosion on the experimental iron plate.
After the drying of the water drop on the surface of the experimental plate there is a spot of gray color, it can be removed with a soft cloth. Surface of the experimental plate have not damage at the end of the experiment. The experimental plate shows variant of cathodic protection, but emission cathode works without an anode — protector as the Qutub Minar Iron Pillar [L 1].
This article is translation into English of the article „Антикоррозийный эффект железного столба Кутуб-Минар демонстрирует учебно — наглядное пособие” [3] by translator http://translate.google.ru
Boris Revashin, 15, April, 2018.
Literature:
- Ревашин Б. Г. „Явление устойчивой электрохимической защиты металлов от коррозии”, Евразийский научный журнал № 9, сентябрь 2015 г., http://journalpro.ru/articles/yavlenie-ustoychivoy-elektrokhimicheskoy-zashchity-metallov-ot-korrozii/
- Гуров А. А., Бадаев Ф. З., Овчаренко Л. П., Шаповал В. Н., Химия. Учебник для вузов. М., изд. МВТУ им. Н.Э. Баумана, 2008. 784 с.
- Золотова Т. С. / Zolotova T. S., Клименко О. Б. / Klimenko O. B., Ревашин Б. Г. / Revashin B. G. „Антикоррозийный эффект железного столба Кутуб-Минар демонстрирует учебно — наглядное пособие” Евразийский научный журнал № 12, декабрь 2015 г., http://journalpro.ru/articles/antikorroziynyy-effekt-zheleznogo-stolba-kutub-minar-demonstriruet-uchebno-naglyadnoe-posobie/









